
Datenintegrität: Neue Herausforderungen und
praktische Lösungen
Bericht von der PDA Regulatory Conference 2025
4 Min. Lesezeit | von Dr. Sabine Paris
Erschienen im LOGFILE 21/2025
Was sind die Herausforderungen und praktischen Lösungen für die Förderung der Datenintegrität? Unsere Redakteurin Dr. Sabine Paris nahm an der PDA Regulatory Conference 2025 teil. In ihrem Bericht fasst sie die wichtigsten Empfehlungen von Vertretern der Industrie und der US-amerikanischen FDA zusammen – und zeigt auf, wie Unternehmen die Datenintegrität in der Praxis stärken können.
Die 34. PDA Regulatory Conference fand vom 8. bis 10. September 2025 in Washington D.C. unter dem Motto „Achieving CGMP Excellence: Sustainable Compliance Across the Lifecycle” statt. Die Sitzungen beleuchteten wichtige CGMP-Säulen, darunter Qualitätssysteme, Anlagen- und Prozessdesign, Lieferantenüberwachung, industrielle Modernisierung und Qualitätsrisikomanagement. Ich hatte die Gelegenheit, online an dieser wegweisenden Konferenz teilzunehmen, an der auch viele Mitarbeitende der US-amerikanischen FDA maßgeblich beteiligt waren. In diesem Artikel konzentriere ich mich auf das wichtige Thema „Datenintegrität”, das sich von einer Best Practice zu einer regulatorischen Anforderung entwickelt hat.
Eine Checkliste zur Datenintegrität ist keine Risikobewertung
Am zweiten Tag der PDA Regulatory Conference 2025 stellte Peter E. Baker (Präsident, Life Oak Quality Assurance) eines klar: „Eine Checkliste zur Datenintegrität ist keine Risikobewertung”. Warum? Weil eine Checkliste alle Arbeitsabläufe als identisch behandelt.
Daten- und Prozess-Governance sind nicht mehr optional – sie sind zu einer regulatorischen Anforderung geworden (z. B. EU-GMP-Anhang 11, ICH E6 (R3) und PIC/S-Leitfaden). Wissenschaftliches Denken basiert auf drei Elementen: Hypothese, Experiment und Theorie. In der pharmazeutischen Herstellung sind die Entsprechungen Design, Betrieb und Überwachung. Der wissenschaftliche Ansatz liefert eine effektive Governance, die nicht nur eine regulatorische Notwendigkeit ist, sondern auch ein strategischer Treiber für den Unternehmenserfolg.
Die Faktoren, die die Gesamtziele Kundenzufriedenheit und Gewinn ermöglichen, sind kontinuierliche Verbesserung, Mitarbeiterengagement und Empowerment (siehe Abbildung 1).
Peter E. Baker schlug die folgenden praktischen nächsten Schritte für die Daten- und Prozesssteuerung vor:
- Erfassen Sie alle Arbeitsabläufe
- Erstellen Sie einen Validation Master File
- Verwenden Sie eine Daten- und Prozesskarte
- Ersetzen Sie FMEAs durch qualitative Risikobewertungen
- Weisen Sie klare Verantwortlichkeiten zu
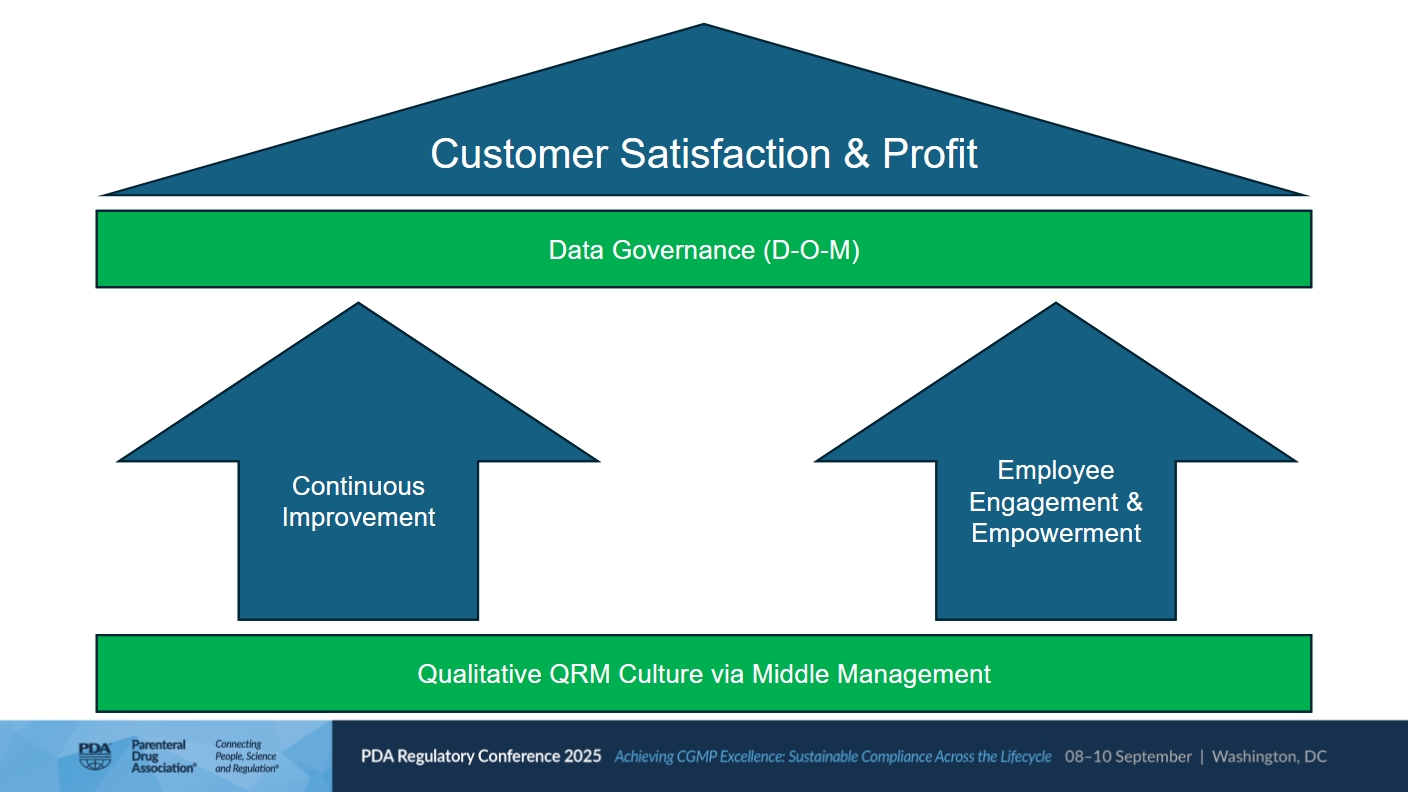
Abbildung 1 | Faktoren für Kundenzufriedenheit und Gewinn (Quelle: Peter E. Baker, PDA Regulatory Conference 2025)
Aufbau resilienter Datensysteme
Carmelo Rosa (Direktor der Abteilung Arzneimittelqualität, CDER) betonte, dass Daten-Governance Datenqualität, Genauigkeit, Konsistenz, Verantwortlichkeiten, Compliance und lebenszyklusumspannendes Management umfasst.
Er unterstrich auch die Bedeutung von Resilienz: Es geht nicht darum, Probleme vollständig zu vermeiden, sondern darum, wie Organisationen sich anpassen, sich erholen und aus ihnen lernen. Eine resiliente Qualitätskultur sorgt dafür, dass Fehler zu Lernen führen – und nicht zu Wiederholungen.
Seit 2014 stellt die FDA immer wieder die gleichen Verstöße gegen die Datenintegrität fest. Einige Unternehmen verfügen nicht über eine effektive Qualitätsstruktur und zuverlässige Systeme. Die Genauigkeit und Integrität der Daten kann nicht ausreichend gewährleistet werden. Qualität ist keine gemeinsame Verantwortung der gesamten Organisation.
Was muss sich ändern?
- Schulungsansätze
- Qualitätskultur mit Verantwortungsbewusstsein
- Auditprogramme
- Personal mit Fachkenntnissen im Bereich Datenintegrität
- Robuste Governance-Strukturen, die auf Vertrauen, Zusammenarbeit und Beteiligung basieren
- Datenintegrität muss als kontinuierlicher, täglicher Prozess betrachtet werden

Abbildung 2 | Data Governance (Source: Carmelo Rosa, PDA Regulatory Conference 2025)











