
Erkenntnis auf den zweiten Blick – Der „menschliche Fehler“ und seine Hintergründe
Ein Auszug aus dem GMP-BERATER, Kapitel 1.E, Abweichungsmanagement
7 Min. Lesezeit | von Dr. Christian Gausepohl
Erschienen im LOGFILE Leitartikel 29/2023
Irren ist menschlich – und wird nur zu gerne als wahrscheinlichste Ursache für Abweichungen aller Art herangezogen. Die betroffene Mitarbeiterin/der betroffene Mitarbeiter wird nachgeschult, ohne Abläufe und Prozesse weiter zu hinterfragen. Die Schulung wird dokumentiert und die Abweichung geschlossen.
Aber ist es wirklich so einfach? Spätestens, wenn die gleiche oder eine ähnliche Abweichung wieder und wieder auftritt, ist es Zeit, genauer nachzusehen.
Dr. Christian Gausepohl beleuchtet im heutigen Leitartikel, was alles hinter dem „menschlichen Fehler“ stecken kann.
Irren ist menschlich – und wird nur zu gerne als wahrscheinlichste Ursache für Abweichungen aller Art herangezogen. Es ist ja auch verlockend einfach, die Fehlerursache im individuellen (Fehl-)verhalten zu suchen. Jeder hat einmal einen schlechten Tag, ist abgelenkt oder unkonzentriert, vergisst oder verwechselt Dinge und macht damit Fehler, obwohl er „eigentlich“ weiß, wie es richtig ist.
Nobody is perfect – und damit wird der Betroffene nachgeschult, ohne Abläufe und Prozesse weiter zu hinterfragen. Die Schulung wird dokumentiert und die Abweichung geschlossen. Aber ist es wirklich so einfach? Spätestens, wenn die gleiche oder eine ähnliche Abweichung wieder und wieder auftritt, ist es Zeit, genauer nachzusehen.
Beispiel für eine Ursachenermittlung
Im Rahmen der visuellen Kontrolle eines Raums vor Aufnahme der Fertigungsaktivitäten wurde festgestellt, dass noch Produktreste vom Vorprodukt erkennbar waren. Die Ursachenermittlung zeigte, dass der Mitarbeiter die Raumreinigung abweichend von der Verfahrensanweisung durchgeführt hat (direkte Fehlerursache). Die bloße Feststellung der Fehlerursache „Mensch“ (human error) reicht hier aber nicht aus. Die weitere Recherche zeigt, dass der betroffene Mitarbeiter nur unzureichend in diesem Reinigungsverfahren geschult war und dementsprechend nicht ausreichend qualifiziert war. Damit müssen auch mögliche Mängel im Schulungssystem (warum war der Mitarbeiter nicht geschult?) sowie im Personalmanagement (wieso wurde ein Mitarbeiter für die Arbeit eingeteilt, für die er nicht qualifiziert war?) als mögliche Ursachenfaktoren (contributing factors) angesehen werden. Gegebenenfalls kann hierbei als zugrunde liegende Ursache (true root cause) ein Managementfehler durch unzureichende Kapazitäten und Ressourcen im Schulungs- bzw. Qualifizierungssystem herauskommen.
Ziel der Ursachenermittlung muss es daher sein, eine oder mehrere Ursachen zu ermitteln. Die Dokumentation hierüber muss sowohl die Ergebnisse, die Begründungen als auch die Ausschlusskriterien aufzeigen. Die Dokumentation muss auch retrospektiv im Fall von späteren Inspektionen oder Beanstandungen sowie weiteren internen Recherchen nachvollziehbar sein.
Was steckt hinter dem „human error“?
Menschliche Fehler werden leicht als Ursache identifiziert. Hier darf die Ursachenermittlung aber nicht aufhören, denn diese Betrachtung bleibt an der Oberfläche, wie in dem o.g. Beispiel verdeutlicht wurde. Auch im EU-GMP-Leitfaden findet sich die Anforderung, nicht einfach mit der bloßen Feststellung „human error“ als Ursache aufzuhören (Abbildung 1).
| Anforderung zu "human error" |
| Wenn ein menschlicher Fehler als Ursache vermutet oder identifiziert wurde, sollte dies begründet werden unter Beachtung, dass sichergestellt wurde, dass verfahrenstechnische oder systembasierte Fehler, sofern vorhanden, nicht übersehen wurden. |
Abbildung 1 Anforderungen EU-GMP-Leitfaden 1.4
Vielmehr kann die Feststellung „human error“ auch als Startpunkt für die weitere Untersuchung angesehen werden. Abbildung 2 zeigt den Zusammenhang von möglichen Grundursachen bei der Feststellung von „human error“.

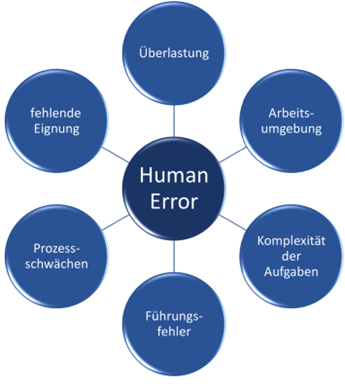

Abbildung 2 Mögliche Grundursachen für einen „Human Error“
Aufstellen und Prüfen von Arbeitshypothesen zur Ursachenermittlung
Bei der Beantwortung der einfachen Ausgangsfrage: Warum wurde die SOP zur Raumreinigung nicht befolgt? müssen viele Fragen in diesem Zusammenhang gestellt werden, und verschiedene zugrunde liegende Ursachen könnten identifiziert werden. In diesem Beispiel sind die wahrscheinlichsten Ursachen als Arbeitshypothesen formuliert und werden mit weiteren Fragen untersucht. Diese Vorgehensweise ermöglicht den Einsatz von vorformulierten Checklisten im Rahmen der Untersuchung und erleichtert damit die Durchführung.
Arbeitshypothese 1: Die SOP war nicht geeignet und der Mitarbeiter konnte diese nicht befolgen.
Möglicherweise enthält die SOP zu viele Details, ist zu komplex oder nicht entsprechend der Zielgruppe geschrieben, d.h. nicht verständlich. Auf der anderen Seite können zu wenige Details auch zu eigenen Interpretationen der Mitarbeiter und möglicherweise zu Abweichungen führen. Daher sollten die Fragen lauten:
- Hat die SOP den betreffenden Arbeitsschritt konkret gefordert?
- Hat die SOP beschrieben, wie der Arbeitsschritt genau durchgeführt werden soll?
- Stellt die SOP die Arbeitswirklichkeit dar, d.h. passen SOP und Arbeitsweise zusammen?
- Gibt es mehrere SOPs, deren Inhalte sich überlappen oder widersprechen?
Arbeitshypothese 2: Die Schulung war nicht geeignet, den Mitarbeiter ausreichend auf die Tätigkeit vorzubereiten.
Idealerweise besteht die Schulung des Mitarbeiters aus mehreren Phasen, d.h. Lesen der SOP, Erlernen der Arbeitsschritte vor Ort (on the job training) und die Überprüfung der Wirksamkeit der Schulung. In einigen Fällen werden reine Leseschulungen durchgeführt oder auch in Kombination mit der Durchführung vor Ort ohne Wirksamkeitsprüfung. Zusätzlich muss vermittelt werden, dass die Mitarbeiter verstehen, dass die Einhaltung der SOPs die einzig akzeptable Art der Ausführung der Arbeitsschritte ist. Daher sollten die Fragen lauten:
- Führen alle Mitarbeiter die Arbeitsschritte auf die gleiche Weise durch?
- War es das erste Mal, dass der Mitarbeiter von der Vorgabe abgewichen war?
- Hat die Schulung den Inhalt der SOP abgedeckt?
- Gab es praktische Übungen hierzu? War die Trainingszeit ausreichend?
- Hat der Schulende überprüft, ob der Mitarbeiter die Arbeitsschritte richtig durchführt? Gegen welche Vorgabe wurde dies geprüft?
- Sind alle Informationen für den zu schulenden Mitarbeiter verfügbar, um die Arbeitsschritte richtig durchzuführen?
- Hat der Schulende die Arbeitsschritte richtig erklärt?
- War der Schulende fachkompetent und verfügt er über die erforderliche Schulungskompetenz?
Arbeitshypothese 3: Der Mitarbeiter ist für die Aufgabe nicht geeignet oder überlastet.
Nicht jeder Mitarbeiter kann für alle Aufgaben geeignet sein. Hier kann es beispielsweise zu Unter- oder Überforderungen kommen. Auch physische Einschränkungen können eine Rolle spielen. Daher sollten folgende Fragen gestellt werden:
- Konnte der Mitarbeiter die Tätigkeit physisch durchführen?
- Verfügt der Mitarbeiter über die entsprechenden Fertigkeiten, Erfahrung und Wissen?
- Hatte der Mitarbeiter genügend Zeit, die Reinigung gemäß SOP durchzuführen?
Arbeitshypothese 4: Das Prozessdesign ist nicht auf die Vermeidung von Fehlern ausgerichtet.
Die Art und Weise, wie die Prozesse aufgesetzt werden, beeinflusst die Fehlerrate bei der Durchführung. Einige Prozesse sind komplex und verfügen über Schnittstellen und Überträge in andere Prozesse. Sowohl lean als auch human error prevention-Programme schauen auf die Identifizierung und Reduktion von Verschwendung (waste) und fehlerträchtigen Arbeitsschritten. Daher sollte im Rahmen der Ursachenanalyse das Prozessdesign betrachtet werden:
- Deckt die SOP den gesamten aktuellen Prozess ab?
- Kann der Mitarbeiter den vorgeschriebenen Prozess in der Praxis so durchführen, wie er in der SOP beschrieben wird? Oder werden verschiedene Personen benötigt? Müssen mehrere Aufgaben gleichzeitig durchgeführt werden?
- Ist der Prozess fehleranfällig und wenn ja, warum?
- Ist die SOP für den Mitarbeiter bei der Tätigkeit verfügbar oder muss er die Tätigkeiten aus dem Gedächtnis durchführen?
Arbeitshypothese 5: Die Arbeitsumgebung ist nicht zuträglich für eine richtige Durchführung.
Die Wahrscheinlichkeit für Fehler steigt, wenn der Mitarbeiter mehrere Aufgaben gleichzeitig durchführt oder häufig unterbrochen wird. Dies ist in erster Linie eine Managementaufgabe, um die Zuordnung und Abstimmung von arbeitstäglichen Aufgaben, Projekten, Terminen sowie Schulungen durchzuführen und so die Fehlerwahrscheinlichkeit zu reduzieren. Dabei sollten folgende Fragen helfen:
- War die Arbeitsbelastung zu hoch, z.B. durch Krankheitsausfälle oder nicht belegte Schichten? Wurden zu viele Aufgaben gleichzeitig auf den Mitarbeiter verteilt?
- War der Mitarbeiter in Eile, um die Vorgaben einhalten zu können? Hätte eine bessere Zeitplanung den Fehler verhindern können?
- Waren die erforderlichen Ressourcen verfügbar (z.B. Arbeitsmaterial oder Mitarbeiter für eine Überprüfung von Arbeitsschritten)?
- Hat der Mitarbeiter nach Unterstützung gefragt und nicht erhalten?
- Sind die Arbeitsbedingungen (z.B. Beleuchtung, Lärm) für die richtige Durchführung des Arbeitsschritts geeignet oder führt Ablenkung zu möglichen Fehlern?
- Hat der Vorgesetzte auch auf die SOP verwiesen, um die Arbeitsschritte korrekt durchzuführen?
Es gibt einige allgemeine Modelle, die bei der Bewertung und Verbesserung von „human error“ herangezogen werden können,z. B. das in Abbildung 3 gezeigte Gilbert-Modell für Verhaltensmodellierung (Gilbert’s Behavioral Engineering Model).
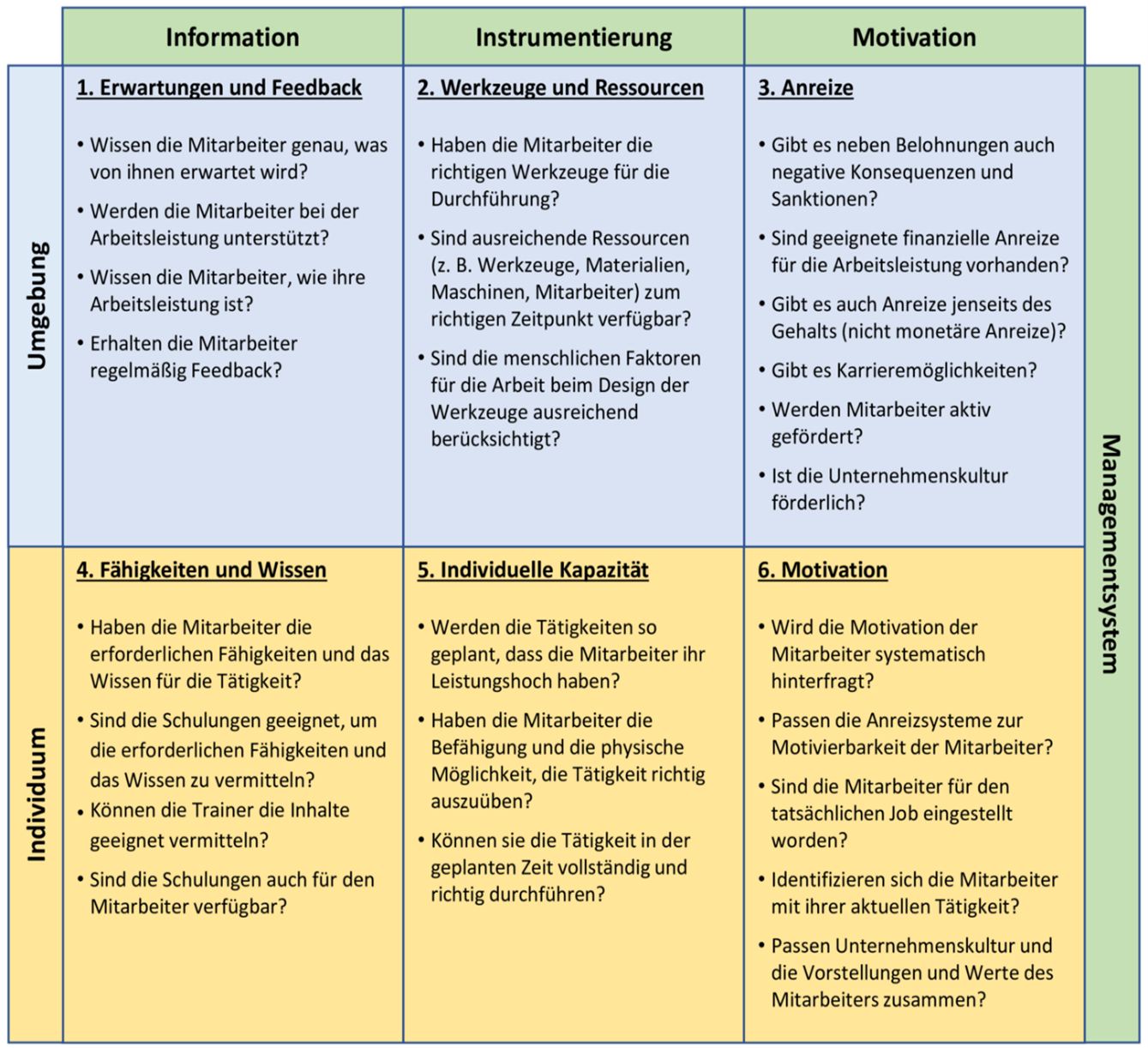
 Abbildung 3 Gilbert-Modell für Verhaltensmodellierung1
Abbildung 3 Gilbert-Modell für Verhaltensmodellierung1
Bei diesem Modell wird davon ausgegangen, dass alle 6 Themenfelder gleich bedeutend sind und adressiert werden müssen, um das menschliche Verhalten positiv zu beeinflussen.
Daraus ergeben sich wichtige Fragestellungen, die die menschliche Fehlerrate beeinflussen:
- Wissen die Mitarbeiter, was von ihnen erwartet wird und sind ihnen die Prioritäten bekannt? Bekommen sie Feedback über ihre Arbeitsleistung im Vergleich zu den Erwartungen?
- Stehen die Arbeitsressourcen zur Verfügung (Geräte, Verfahren, Umgebung, Zeit) und sind diese dazu geeignet, die Arbeitsleistung zu verbessern? Gibt es sich widersprechende oder konkurrierende Anforderungen und Aufgaben?
- Welche Anreize gibt es, um die Aufgaben richtig durchzuführen? Wird richtige Durchführung belohnt und schlechte Durchführung angesprochen?
- Haben die Mitarbeiter das Wissen und die Fertigkeiten, um die Aufgaben wie erwartet durchzuführen, und werden diese in geeigneter Form vermittelt?
- Sind die Mitarbeiter physisch in der Lage, die angeordnete Aufgabe richtig durchzuführen? Ist die Aufgabe für eine Zeit des Leistungshochs geplant? Sind die vorgesehenen Bearbeitungszeiten realistisch?
- Unterstützt die Arbeitskultur die richtige Durchführung der Aufgabe? Sind die persönlichen und die Unternehmensanreize aufeinander abgestimmt?
1 modifiziert nach Deb. Wagner, Human Performance Technology Toolkit
FAZIT : Für die nachhaltige Verbesserung ist die Qualitätskultur des Unternehmens von großer Bedeutung. Dazu gehört die offene Auseinandersetzung mit den eigentlichen Gründen von „human error“. Dies stellt eine Herausforderung dar, die sicherlich nicht bequem ist und den vom Management getragenen Willen voraussetzt, in diesem Feld kontinuierlich Verbesserung erreichen zu wollen.
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








