
Fortschrittliche Medizin: Arzneimittel für neuartige Therapien (ATMPs) – Teil 1
7 Min. Lesezeit | von Dr. Birte Scharf
Erschienen im LOGFILE 7/2024
ATMP – vier Buchstaben, hinter denen sich viel verbirgt: bahnbrechende Fortschritte, große Hoffnungen und zukunftsweisende Chancen für die Behandlung schwerer und seltener Erkrankungen. Aber auch regulatorische Hürden, ethische Bedenken und technologische Herausforderungen. Verschaffen Sie sich einen ersten Überblick über diese komplexe Thematik!
Im heutigen Leitartikel stellt Dr. Birte Scharf die verschiedenen Kategorien der ATMPs, ihre prinzipielle Wirkungsweise und möglichen Einsatzgebiete vor.
Was sind Arzneimittel für neuartige Therapien (ATMPs)?
Arzneimittel für neuartige Therapien (Advanced Therapy Medicinal Products, ATMPs) sind eine innovative Klasse von Arzneimitteln, die sich durch den Einsatz fortschrittlicher Technologien auszeichnen.
Sie adressieren direkt die zugrunde liegenden genetischen, zellulären oder gewebebasierten Anomalien von Krankheiten und bieten damit das Potenzial für eine Heilung oder zumindest einen langfristigen therapeutischen Nutzen.
Im Gegensatz zu konventionellen Arzneimitteln, die häufig Symptome behandeln, ermöglichen ATMPs in einigen Fällen sogar die Bekämpfung der Krankheitsursachen, etwa wenn ein ursächlicher Gendefekt korrigiert werden kann.
Das Gebiet der ATMP entwickelt sich rasch und dynamisch, angetrieben durch bedeutende technologische und wissenschaftliche Fortschritte in Biotechnologie und Medizin. Diese Therapien, zu denen Gentherapie, Zelltherapie, Tissue Engineering und deren Mischformen gehören, bieten neue Lösungen für komplexe medizinische Herausforderungen. Sie eröffnen neue Möglichkeiten zur Behandlung von Krankheiten, für die bisher keine oder nur unzureichende Therapieoptionen existieren. Die Hoffnungen auf Advanced Therapy Medicinal Products sind groß - ob bei Krebs, Erbkrankheiten oder regenerativer Medizin.
Dieser Beitrag erläutert im ersten Teil die Definition von ATMPs und ihre Kategorien. Im zweiten Teil folgt ein Einblick in den rechtlichen Rahmen und die speziell auf ATMPs zugeschnittenen Richtlinien der Europäischen Union zur Guten Herstellungspraxis (GMP) (EU-GMP-Leitfaden Teil IV), sowie eine Betrachtung von Herausforderungen bei der ATMP-Herstellung.
Welche Kategorien von ATMPs gibt es?
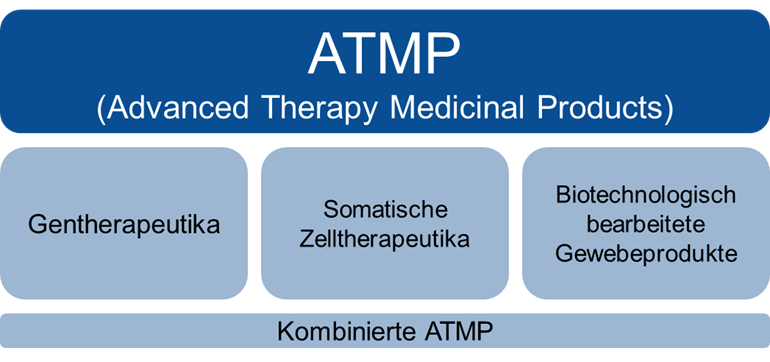
Abbildung 1: Kategorien von ATMPs
Gentherapeutika:
Bei der Gentherapie wird genetisches Material in die Zellen oder das Gewebe eines Patienten eingebracht, um abnormale Gene, die für die Entwicklung einer Krankheit verantwortlich sind, zu korrigieren oder zu kompensieren. Dies kann durch verschiedene Verabreichungsmethoden erreicht werden, darunter virale Vektoren, nicht-virale Vektoren oder Genom-Editing-Techniken wie CRISPR-Cas9.
Die Gentherapie birgt ein immenses Potenzial für die Behandlung eines breiten Spektrums von Krankheiten, einschließlich genetischer Störungen, bestimmter Krebsarten und erworbener Erkrankungen. Indem sie auf die zugrunde liegende genetische Ursache von Krankheiten abzielt, bietet die Gentherapie die Möglichkeit, langfristige oder sogar dauerhafte Behandlungsergebnisse zu erzielen.
Beispiel: 2017 wurde Luxturna® von der US-Arzneimittelbehörde FDA für die Behandlung von erblichen Netzhauterkrankungen zugelassen, die durch Mutationen im RPE65-Gen verursacht werden. Luxturna® bringt eine funktionsfähige Kopie des RPE65-Gens in die Netzhautzellen ein und stellt so die Sehkraft der betroffenen Personen wieder her.
Neben den klassischen Gentherapien gibt es noch die zellbasierten Gentherapien, bisher zugelassen sind ausschließlich CAR-T-Zell-Therapien (Chimeric Antigen Receptor T-cell). Bei diesen werden die eigenen T-Zellen eines Patienten genetisch so verändert, dass sie Rezeptoren exprimieren, die Krebszellen erkennen und angreifen. CAR-T-Zell-Therapie wird derzeit zur Behandlung bestimmter Arten von Blutkrebs wie Leukämie und Lymphomen eingesetzt, es gibt aber auch Ansätze zum Einsatz bei soliden Tumoren.
Somatische Zelltherapeutika:
Die Zelltherapie macht sich die Regenerationsfähigkeit lebender Zellen zunutze, um die Zellfunktion in erkranktem oder geschädigtem Gewebe wiederherzustellen oder zu verbessern. Diese Zellen können vom Patienten (autolog) oder von einem Spender (allogen) stammen und werden in der Regel durch Injektion oder Infusion verabreicht. Diese Zellen können vor der Verabreichung ex vivo manipuliert oder modifiziert werden, um bestimmte Krankheitsmechanismen anzugehen.
Beispiel: Alofisel® ist ein somatisches Zelltherapeutikum, das aus Stammzellen aus dem Fettgewebe eines gesunden Spenders besteht. Dieses Mittel wird zur Behandlung von komplexen Analfisteln bei Erwachsenen mit Morbus Crohn eingesetzt. Die Stammzellen werden in die Fisteln injiziert, verringern die Entzündung, fördern das Gewebewachstum und führen so zu Heilung und Verschluss der Fisteln.
Biotechnologisch bearbeitete Gewebeprodukte („Tissue Engineering“):
Beim Tissue Engineering werden Zellen, Biomaterialien und biochemische Faktoren kombiniert, um funktionelle Gewebeersatzstoffe für die Transplantation oder Regeneration zu schaffen. Bei diesem Ansatz werden dreidimensionale Strukturen konstruiert, die den Aufbau und die Funktion von nativem Gewebe nachahmen und die Gewebereparatur oder -regeneration fördern.
Tissue Engineering hat das Potenzial, ein breites Spektrum medizinischer Bedürfnisse zu erfüllen, einschließlich der Reparatur beschädigter Gewebe, des Ersatzes von Organen und der Förderung der Geweberegeneration. Zu den Anwendungen des Tissue Engineering gehören Hauttransplantate für Verbrennungspatienten, Knorpelreparatur in der orthopädischen Chirurgie und biotechnologisch hergestellte Organe für Transplantationen.
Beispiel: Im Bereich der Orthopädie werden gewebetechnische Knorpelkonstrukte als Alternative zu herkömmlichen Knorpelreparaturverfahren für Erkrankungen wie Arthrose entwickelt. Diese Konstrukte, die aus Chondrozyten bestehen, die in biokompatible Gerüste eingebettet sind, sollen den geschädigten Knorpel regenerieren und die Gelenkfunktion wiederherstellen.
Kombinierte ATMPs:
Einige Therapien kombinieren Elemente der Gentherapie, der Zelltherapie und des Tissue Engineering, um komplexe medizinische Herausforderungen umfassend anzugehen. Diese kombinierten ATMPs nutzen mehrere Ansätze, um synergistisch auf verschiedene Aspekte der Pathophysiologie von Krankheiten einzuwirken.
Beispiel: Künstlich hergestellte autologe Hautersatzmaterialien kombinieren Elemente des Tissue Engineering und der Zelltherapie zur Behandlung schwerer Verbrennungen und chronischer Wunden. Diese Konstrukte bestehen aus vom Patienten stammenden Hautzellen, die auf biokompatiblen Gerüsten gezüchtet werden und die Wundheilung und Geweberegeneration fördern.
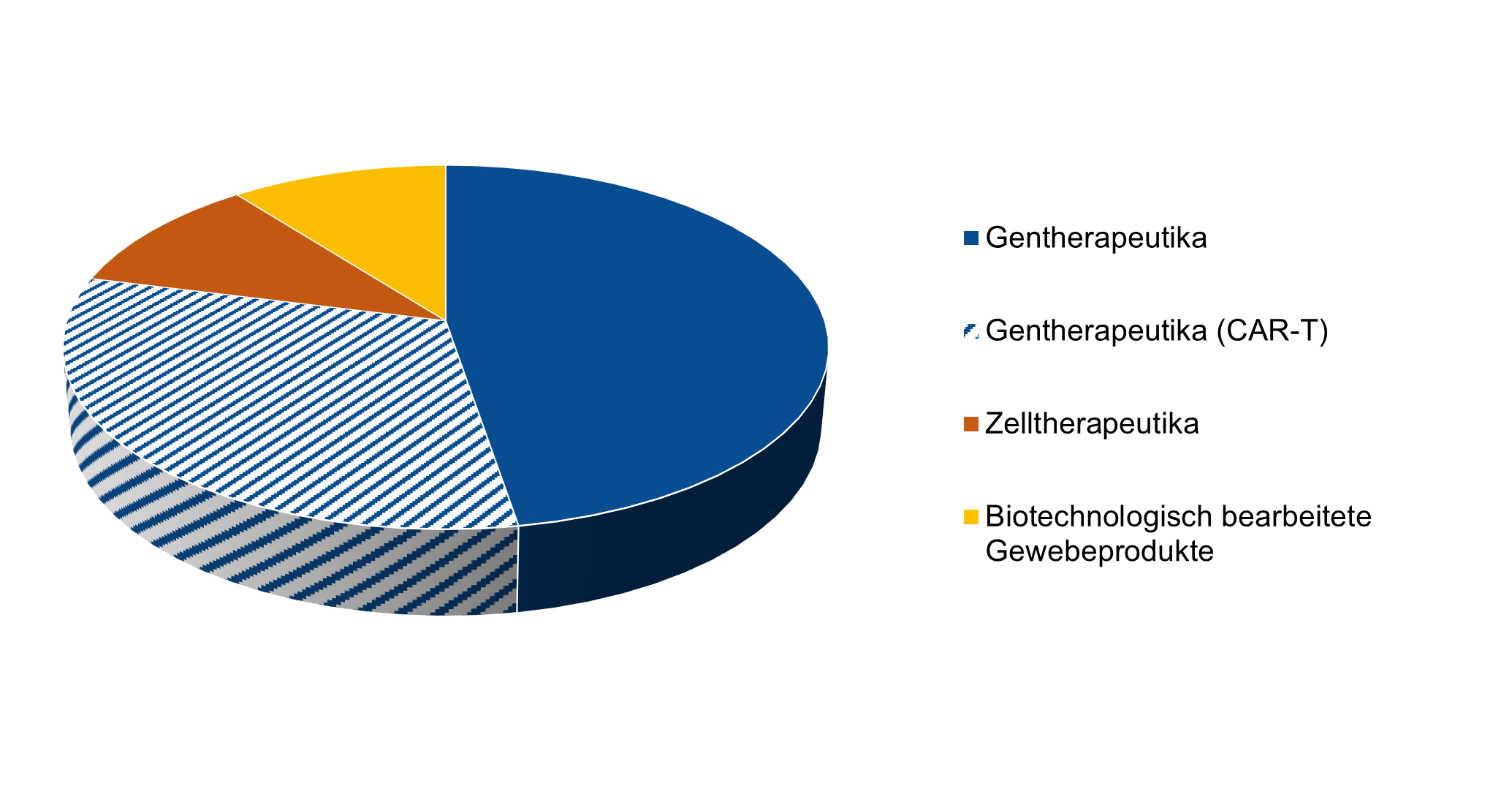
Abbildung 2: Laut EMA zugelassene ATMPs (19.03.2024).
Lesen Sie im nächsten LOGFILE, welche regulatorischen Anforderungen im Zusammenhang mit ATMPs zu beachten sind und welche Herausforderungen bei der Herstellung von ATMPs bestehen.
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








