
GMP ist nicht ISO 9001 – wo sind die Gemeinsamkeiten und Unterschiede?
Auszug aus dem GMP-Webcast GMP & TEA, Episode 25 „GMP ist nicht ISO 9001“
7 Min. Lesezeit | von Thomas Peither
Erschienen im Logfile 43/2022
Immer wieder erreichen uns im GMP-Verlag Fragen zum Vergleich von ISO 9001 mit GMP, und Thomas Peither hat zu dem Thema viel recherchiert, aber kaum etwas Handfestes gefunden. Daher bekommen Sie mit der Episode 25 des GMP-Webcasts GMP & TEA "GMP ist nicht ISO 9001" exklusive Informationen vom GMP-Verlag zu diesem wichtigen Thema.
Im Leitartikel lesen Sie in einem Auszug aus der Episode 25 über die Ziele und Gemeinsamkeiten von GMP und ISO 9001.
Normen wie die der DIN EN ISO Reihe sind keine Gesetze, daher unterscheiden sich ISO-Normen ganz grundlegend von rechtlich bindenden Vorschriften. Die Good Manufacturing Practice (GMP oder Gute Herstellungspraxis) hingegen ist in Gesetzen, Verordnungen und Richtlinien niedergelegt.
Immer wieder erreichen uns im GMP-Verlag Fragen zum Vergleich von ISO 9001 mit GMP und ich habe in den letzten Wochen viel recherchiert, aber kaum etwas dazu gefunden. Daher bekommen Sie mit der GMP-Webcast GMP & TEA-Episode 25 exklusive Informationen zu diesem wichtigen Thema!
ISO 9000 & ISO 9001 – „freiwillig“
Die ISO 9000 Familie und damit die ISO 9001 beschreibt, wie die Qualität von Produkten und Dienstleistungen verbessert und die Erwartungen der Kunden konsequent erfüllt werden können. Die ISO 9001 ist somit ein Werkzeugkasten für all diejenigen, die ein Qualitätsmanagement in Unternehmen oder Organisationen etablieren oder aufrecht erhalten wollen beziehungsweise müssen. Zugleich kann die erfolgreiche Umsetzung zertifiziert werden.
Wichtig ist dabei, dass es von Seiten des Gesetzes keine Verpflichtung zur Zertifizierung gibt - auch wenn diese in verschiedenen Branchen Grundvoraussetzung ist, wenn man im Wirtschaftsleben mitspielen möchte.
GMP-Anforderungen – „verpfichtend“
Gesetze, Verordnungen oder Richtlinien hingegen sind Pflicht für jeden Arzneimittelhersteller. Der Gesetzgeber verlangt und überwacht die Einhaltung der Anforderungen und kann die Herstellungserlaubnis versagen oder zurückziehen, wenn die Vorgaben nicht angemessen umgesetzt werden.
Die nationalen Überwachungsbehörden, die in nahezu jedem Land unterschiedlich organisiert sind, inspizieren die GMP-Konformität durch regelmäßige Besuche in den Fabriken.
Ein wichtiger Unterschied ist daher, dass ISO „freiwillig“ ist und GMP „verpflichtend“.
Ziele von ISO 9001 und GMP
Auch die Ziele von ISO 9001 und GMP unterscheiden sich: Während die ISO 9001 die Verbesserung von Produkten und Prozessen im Blick hat, fokussieren die GMPs auf die Erfüllung von Qualitätsanforderungen.
Im Prinzip nähert sich die ISO den Lösungen über das Management und die Verbesserung von Qualitätsprozessen mit Hilfe des Risikomanagements, während die GMPs die Produkte zunächst von Seiten der Qualitätskontrolle betrachten.
Beide Regelwerke wollen Produkte mit hoher Qualität erreichen, die ISO konzentriert sich dabei mehr auf das Gesamtunternehmen und GMP auf die Erfüllung von Produktattributen. Eine lange Liste, die Sie bestimmt auch noch fortsetzen können. Wie Sie die Inspektionsfelder auswählen, bleibt am Ende Ihnen überlassen. Die Auswahl muss vor allem zu ihrem Qualitätsmanagementsystem passen. Sie kann abteilungsorientiert, prozessorientiert oder systemorientiert erfolgen. Jede dieser Varianten hat Vor- und Nachteile und sie müssen abwägen, welche in ihrem speziellen Fall am besten funktioniert.
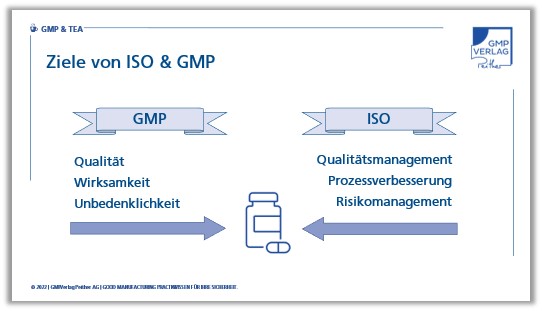
Die GMPs haben sich in den letzten Jahren oder Jahrzehnten stark verändert und weiterentwickelt. So findet man heute auch die Themen Risikomanagement und Verbesserungsprozesse in der GMP-Welt. Das war vor 25 Jahren, als ich mich erstmals mit GMP beschäftigte anders. Seinerzeit hatte die Qualitätskontrolle eine viel größere Bedeutung als heute.
Gemeinsamkeiten von ISO 9001 und GMP
ISO 9001 und GMP haben viel gemeinsam. Wobei ich mich in dieser GMP & TEA-Episode auf die EU-GMPs konzentriere. Die Komplexität würde enorm steigen, wenn wir beispielsweise auch die US-GMPs berücksichtigen würden. Vereinfacht würde ich sagen, dass die EU-GMPs mehr Gemeinsamkeiten mit der ISO 9001 haben als die US-GMPs. Gemeinsamkeiten sind z.B.:
- Sicherstellung der Produktion qualitativ hochwertiger Produkte
- Prozessbeschreibungen, die das Ziel hoher Qualität unterstützen
- Einführung eines Qualitätsmanagementsystems
- Einbindung des Top-Managements
- Fokus auf Produktionseinrichtungen
- Hygiene, Monitoring und Kalibrierung
- Dokumentenmanagement
- Änderungswesen
- Lieferantenaudits
- Produkt-Qualitätsprüfungen
- Batchdokumentation
- Material-Identprüfungen
- Prozesse für Abweichungen & CAPA
- Prozess- und Produktüberwachung
- Selbstinspektionen
- Kundenreklamationen
Unterschiede von ISO 9001 und GMP
Auch hier fokussieren wir auf die EU-GMPs und lassen die US-GMPs außen vor. Unterschiede betreffen u.a. die Methodenvalidierung und die Vermeidung von Kreuzkontaminationen.
Genaueres zu den Unterschieden, weitere Details sowie ein Fazit und drei Tipps für die GMP-Praxis erfahren Sie in der kompletten GMP & TEA-Webcastfolge 25 „GMP ist nicht ISO 9001“.
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








