
GMP, Wirtschaftlichkeit und Ethik – ein Gegenspiel oder Synergie?
6 Min. Lesezeit | von Dr. Felix Kern und Dr. Hansjörg Hagels
Erschienen im LOGFILE 2/2024
Ein pharmazeutischer Herstellungs- und Prüfbetrieb kann aus verschiedensten Blickwinkeln betrachtet werden, die wir im Folgenden auf drei Perspektiven verdichten werden.
Wie in der Abbildung 1 dargestellt, gibt es die Komponente der Qualität, die sich auf das Arzneimittel und die Patienten fokussiert (im Folgenden GMP genannt), eine Wirtschaftlichkeitskomponente, die sich auf die Rentabilität des Betriebs fokussiert, und eine ethische Komponente, die sich beispielsweise auf den Mitarbeitenden, das Team und auf die Nachhaltigkeit (Sustainability) fokussiert.
Die Frage ist nun, ob sich diese drei Blickwinkel generell widersprechen oder ob es gelingen kann, sie zu einem mächtigen Instrument zu entwickeln, wenn man diese in Einklang bringen könnte.
Zuerst wollen wir etwas näher auf die Definition von GMP, Wirtschaftlichkeit und Ethik eingehen. Anschließend werden wir verschiedene Beispiele beleuchten, die demonstrieren, dass es Spannungsfelder zwischen diesen Größen gibt, aber dass es sich immer lohnt, hier einen Konsens zwischen diesen zu finden.
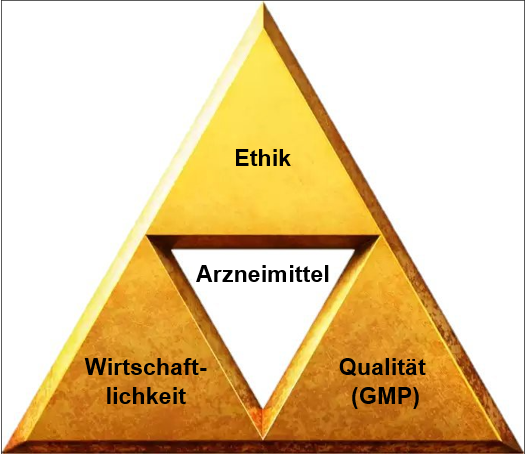
Abbildung 1 Drei Blickwinkel: GMP, Wirtschaftlichkeit und Ethik
Definitionen
Definition GMP
„Gute Herstellungspraxis ist der Teil des Qualitätsmanagements, der gewährleistet, dass die Produkte gleichbleibend nach den Qualitätsstandards hergestellt und geprüft werden, die der vorgesehenen Verwendung und der Arzneimittelzulassung oder der Genehmigung der klinischen Prüfung oder der Produktspezifikation entsprechen.
Gute Herstellungspraxis betrifft sowohl die Produktion als auch die Qualitätskontrolle.“
(Kapitel 1, Teil 1, EU-GMP-Leitfaden)
Man erkennt in der Definition von GMP des EU-GMP-Leitfadens eindeutig den Fokus auf das Arzneimittel selbst und auf dessen Qualität.
Definition Wirtschaftlichkeit
„Die Wirtschaftlichkeit steht für das Verhältnis des Unternehmenserfolgs zu den eingesetzten Kosten. Steigen die Unternehmenserträge und sinken die Kosten, erhöht sich die Wirtschaftlichkeit. Nehmen die unternehmerischen Aufwendungen überhand, sinkt die Wirtschaftlichkeit des Unternehmens.“ (bwl-lexikon.de)
Der oben aufgeführten Definition folgend, fokussiert sich die Wirtschaftlichkeit auf den Erfolg des Produktes, also beispielsweise die Absatzzahlen, die den Kosten für das Produkt, für die ethischen Komponenten, wie Arbeitssicherheit und Sustainability, und der Qualität gegenübergestellt werden.
Definition Ethik
„Gesamtheit sittlicher Normen und Maximen, die einer [verantwortungsbewussten] Einstellung zugrunde liegen“ (duden.de)
Die Ethik stellt Regeln auf, die für alle Menschen gelten sollen. Diese Regeln helfen den Menschen, ein berechenbares Leben zu führen, sie geben Sicherheit. Auf Basis dieser Regeln lässt sich reproduzierbar entscheiden, was gut und was schlecht, was richtig und was falsch ist.
Beispiele
Beispiel: Spannungsfeld GMP und Wirtschaftlichkeit
Als Paradebeispiel für den Kontrast von Qualitäts- und Wirtschaftlichkeitsanforderungen ist der Contergan-Skandal herauszustellen. Obwohl es vom Markt und von Patienten eine enorme Anzahl an Reklamationen gab, die im Zusammenhang mit den heftigen Nebenwirkungen um den Wirkstoff Thalidomid standen, wurde kein Rückruf über Jahre durchgeführt. Dass bei dieser Entscheidung der wirtschaftliche Fokus die Patienten- und die Qualitätssicht übertrumpft hatte, liegt auf der Hand.
Aus wirtschaftlicher Sicht sind jedoch auch die Konsequenzen dieser Entscheidungen mit einzubeziehen. Die direkten Kosten für Klagen und Schadensansprüche als auch die indirekten Kosten wie eine Rufschädigung sollten berücksichtigt werden.
Aus diesem Grund kann auch bei diesem Beispiel nicht von einem Gegeneinander von GMP und Wirtschaftlichkeit gesprochen werden. Die beiden müssen Hand in Hand gehen, damit die Folgekosten für den nicht erfolgten Rückruf und die gemeldeten Qualitätsprobleme minimiert werden können.
Beispiel: Spannungsfeld GMP und Ethik
Als gutes Beispiel hierfür kann der Verwurf von Reinigungsmitteln in einem Reinigungsbereich aufgeführt werden. Trotz modernster Technik ist es nicht immer möglich, das gesamte Reinigungsmittel aus einem Reinigungskanister der Waschstation zuzuführen. Die Konsequenzen sind, dass die Restreinigungsmittelreste gesammelt und anschließend verworfen werden. Die Frage ist, ob das Verwerfen wirklich aus GMP-Sicht nötig ist.
Ist es möglich, Restreinigungsmittel einer Charge in einen Reinigungskanister einer anderen Charge, aber desselben Reinigungsmittels, umzupumpen und dadurch die Reinigungsmittelreste doch zu verwenden? Wie kann diese Vermischung von Reinigungsmittelchargen gerechtfertigt werden, um Verschwendung zu verhindern? Auch hier müssen Nachhaltigkeit und GMP Hand in Hand gehen, um die bestmöglichste Lösung für dieses Problem zu finden.
Beispiel: Spannungsfeld Ethik und Wirtschaftlichkeit
Auch zur Veranschaulichung dieses Spannungsfeldes lässt sich der Contergan-Skandal als Beispiel heranziehen. Denn obwohl sich im Laufe der Vermarktungsjahre zwischen 1957 und 1961 mehr und mehr herauskristallisierte, dass es eine Korrelation zu Neugeborenen mit körperlichen Fehlbildungen gab, zog das Unternehmen es vor, weiterhin die Produktion voranzutreiben und intensiv für die Vermarktung des Arzneimittels zu werben.
Wie zuvor bereits beschrieben, übertrafen die Gerichts- und Wiedergutmachungskosten (soweit man hier überhaupt noch etwas wiedergutmachen konnte) bei Weitem die Gewinne der Vermarktungsjahre.
Beispiel: Spannungsfeld GMP, Wirtschaftlichkeit und Ethik
Ein Beispiel, welches das Zusammenspiel von GMP, Wirtschaftlichkeit und Ethik demonstriert, ist die Einführung einer Continuous-Manufacturing(CM)-Linie. Aus wirtschaftlicher Sicht stellt eine CM-Anlage für einen 24/7-Betrieb eine Möglichkeit dar, die Lead Time zu reduzieren, Wege zu reduzieren und die Produktion „leaner“ zu gestalten.
Aus ethischer und Arbeitssicherheitssicht kann durch eine CM-Anlage der Bediener besser geschützt werden, da wir einen zumeist komplett geschlossenen Prozess haben, weniger aus Containern umgefüllt werden muss und dadurch der Bediener auch weniger schweren physischen Anstrengungen ausgesetzt ist. Also hat sowohl die Wirtschaftlichkeit als auch der Fokus Ethik ein eindeutiges Interesse an einer CM-Anlage, abhängig von der Auslastung der Anlage und abhängig vom Produkt selbst.
Für die Qualitätssicherung stellt eine CM-Anlage allerdings eine besondere Herausforderung dar, auf die die ICH Guideline Q13 gesondert eingeht. Wie geht man mit Disturbances um, die sich in der CM-Anlage ereignet haben? Wo liegen die Diversion Points? Wie kommunizieren die PAT-Sensoren miteinander und wie kann anhand eines Funnel Plots entschieden werden, ob das Material aus der CM wirklich den Spezifikationen entspricht oder nicht?
Die oben aufgeführten Beispiele zeigen, dass ein Zusammenspiel aus Wirtschaftlichkeit, GMP/Qualität und Ethik in einem pharmazeutischen Herstellungs- und Prüfbetrieb unabdingbar ist.
Diese unterschiedlichen Blickwinkel sollten Synergien entwickeln und sich gegenseitig ergänzen. Werden die Daten aus den PAT-Sensoren einer CM wirklich nur für das Monitoring verwendet, oder werden die Daten auch genutzt, um den Prozess zu optimieren und dadurch wirtschaftlicher und sicherer zu machen?
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








