
Innovationen in der pharmazeutischen Produktion
Konferenzbericht: PDA Annual Meeting, 15. bis 17. März 2021
10 Min. Lesezeit | von Thomas Peither
Erschienen im LOGFILE Leitartikel 20/2021
Konnten Sie in diesem Jahr das Annual Meeting der Parenteral Drug Association (PDA) verfolgen?
Oder ging es Ihnen wie vielen anderen, die den ganzen Tag in Web-Meetings verbrachten und weder Zeit noch Lust auf weitere Online-Konferenzen hatten?
Wir haben das virtuelle PDA Annual Meeting 2021 besucht und im Folgenden gebe ich Ihnen einen kurzen Einblick in einige Vorträge mit dem Schwerpunkt GMP.
Zu allererst möchte ich die sehr gute Organisation hervorheben. U. a. war es sehr hilfreich, die Präsentationen vor der Veranstaltung herunterladen zu können. So konnten wir den Vorträgen besser folgen, und es war auch einfacher, Fragen zu formulieren. Der Vorteil dieser Vorgehensweise zeigte sich an der großen Anzahl von Fragen und den interessanten Diskussionen.
Ich fand die virtuelle Stadtführung durch New Orleans, die Kaffeepausen mit Musik und Unterhaltung sehr inspirierend. Davon können andere Organisatoren lernen!
Wie PDA-Präsident Richard Johnson bestätigte, werden zukünftige Annual Meetings als Hybrid-Veranstaltungen geplant. Und ich würde mich freuen, wenn z. B. Stadtführungen dann auch vor Ort stattfinden würden – aber das nur nebenbei.
Präsident und CEO Richard Johnson, Jette Christensen und Susan Schniepp, die Konferenzvorsitzenden, eröffneten das virtuelle PDA Annual Meeting.
Analytisches Zielprofil und Zielmessunsicherheit
"ICH Q14 wird ein Konzept für eine übergreifende analytische Methodenentwicklungsstrategie etablieren", so Robert Mayer von Novartis. Analytical Quality by Design (aQbD) steht für ihn für einen strukturierten Methodenentwicklungsansatz, Know-how-Transfer und ein vereinfachtes wissenschaftsbasiertes Change Management.
Das analytische Zielprofil (analytical target profile, ATP) ist ein zentrales Dokument zum Start und zur Unterstützung des Lebenszyklusprozesses. Es ist eine prospektive Beschreibung der gewünschten Leistungsparameter der Methode. Es sollte für alle hochkritischen Qualitätsattribute vorhanden sein und ist eine Grundlage für die Methodenauswahl.
In seinem Vortrag ging er auch auf mögliche Fragestellungen und Hindernisse bei der Einrichtung eines ATP ein.
Das ist der Grund, warum er sich auf die Zielmessunsicherheit (target measurement uncertainty, TMU) konzentrierte. Robert Mayer identifizierte die TMU als ein Schlüsselwerkzeug für die Definition von ATP-Anforderungen. Weitere Punkte in seinem Vortrag waren Methodenrisikoanalyse, statistische Versuchsplanung (design of experiments, DoE), analytische Kontrollstrategie, Risiko- und Änderungsbewertung.
Dies war ein gutes Beispiel dafür, wie innovative Methoden die Branche in die Zukunft führen können.
Verbesserung des Wissenstransfers zur Risikoreduzierung und zum Nutzen der Patienten
“Qualitätsrisikomanagement und Wissensmanagement sind stark voneinander abhängig. Aber in den Pharmafirmen sind sie überhaupt nicht miteinander vernetzt.” So eröffnete Marty Lipa, Merck & Co., seinen Vortrag mit dem Titel "Holding on to What You Know: Improving Knowledge Transfer to Reduce Risk and Benefit Patients".
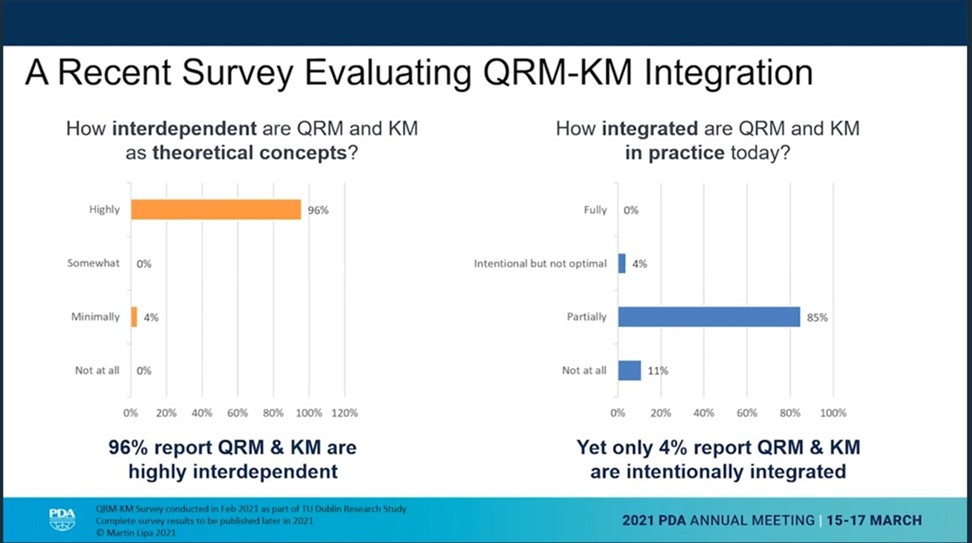

Er beschrieb das Konzept des kontinuierlichen und immerwährenden "Risk-Knowledge Infinity Cycle". Das Risiko nimmt ab, während das Wissen zunimmt. Unter Verweis auf ICH Q10 könnte das Risiko-Wissen-Rahmenwerk eine Lösung sein, wenn es angemessen angewendet wird.
Marty Lipa beschrieb mit einigen sehr guten Folien die heutigen Herausforderungen des Wissenstransfers. Ein wichtiger Punkt sind die Mindestanforderungen für die erfolgreiche Herstellung einer Charge. Durch die starke Fixierung auf Dokumente geht allerdings implizites Wissen verloren. Darüber hinaus gibt es viele Wissensverluste in der Entwicklung und/oder der vorkommerziellen Herstellung – eine Menge Wissen geht verloren.
Mit dieser Erfahrung führte Marty Lipa auch ein Effektivitäts-Toolkit ein und testete Werkzeuge, um auch implizites Wissen transferieren zu können.
Automatisierte fortlaufende Prozessverifizierung
Disruptive Technologien & GMP live erleben: Die Continued Process Verification (CPV) ist die dritte Stufe der FDA-Prozessvalidierung. Sie beweist, dass ein Herstellungsprozess konsistent und GMP-konform arbeitet. Für jedes Produkt müssen regelmäßig Berichte mit Statistiken für mehrere CQAs und CPPs, Abweichungen, Trends und Erläuterungen erstellt werden. Diese Berichte sind mit einem hohen Aufwand verbunden.
Ashwin Monian zeigte in seinem Vortrag sehr anschaulich, wie Merck & Co diesem Aufwand mit einer automatisierten Lösung begegnet. Der Titel seines Vortrags lautete "Automated CPV Reporting: From Routine Compliance Exercise to State-of-the-Art Process Monitoring ".
Ashwin Monian berichtete mit großer Begeisterung über dieses bahnbrechende Projekt. Sich wiederholende und manuelle Aufgaben wurden automatisiert und damit obsolet. Es wurden neue Datenbankstrukturen und eigene Softwareanwendungen entwickelt. Als Ergebnis kann das Grundgerüst der entsprechenden Berichte innerhalb von Minuten erstellt und zur Überprüfung verschickt werden.
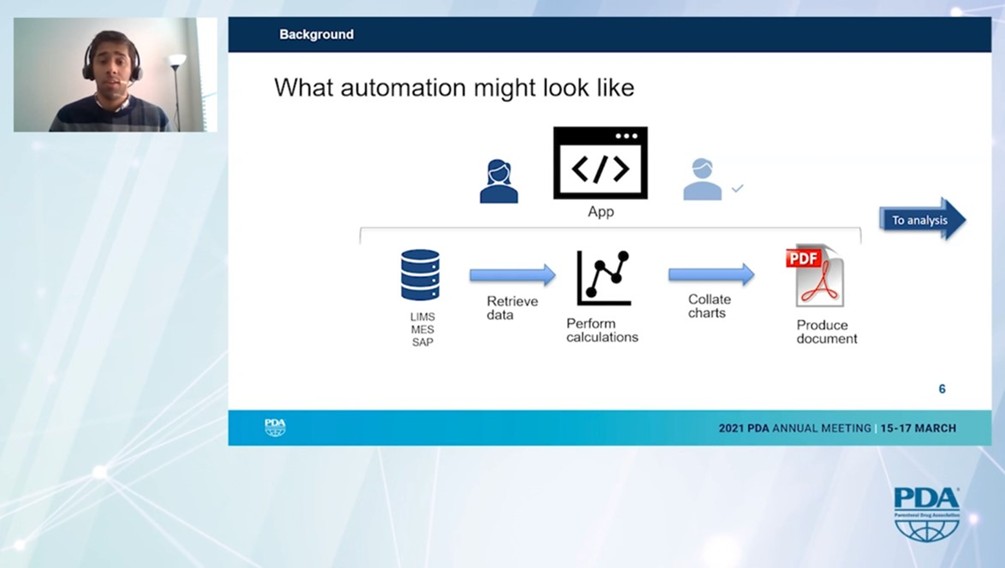

Durch die Automatisierung wurde die Fehlerquote deutlich reduziert und die Effizienz der Berichterstellung massiv gesteigert: Früher dauerte es mehrere Wochen, heute nur noch Minuten.
Die GMP-konforme, automatisierte CPV-Software wurde in Zusammenarbeit mit Manufacturing Sciences und IT entwickelt. Sie wurde bereits an fünf Standorten implementiert und wird bis 2022 konzernweit vollständig integriert sein.
Dieses Projekt ist ein Leuchtturm im oft noch konservativen Pharmaumfeld. Wir wünschen uns mehr Präsentationen wie diese, die beweisen, dass disruptive Ansätze in einem GMP-regulierten Umfeld möglich und lohnenswert sind!
Organisation, Governance und Kompetenzentwicklung
Mauro Giusti, Eli Lilly Italia, hielt einen beeindruckenden Vortrag mit dem Titel: "Organisation, Governance and Competency Development for Successful Parenteral Manufacturing".
Bemerkenswert war die Darstellung der Unterstützungsschleifen in der Organisation. Er unterschied zwischen der "Variabilitätsreduktionsschleife" auf Shopfloor- und Teamebene, der "Verbesserungsschleife" für das technische Team und der "Durchbruchsschleife" auf Standortebene.
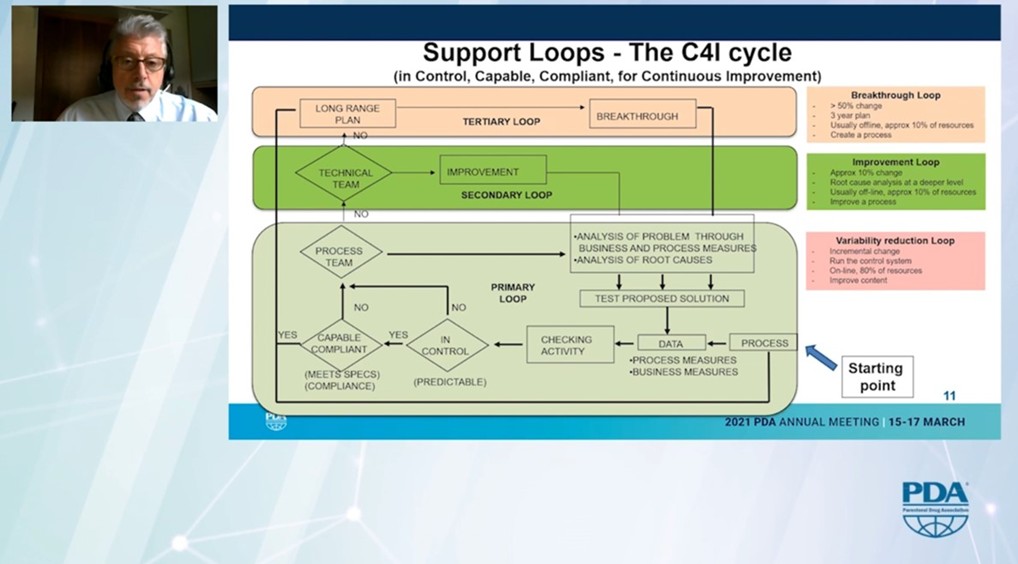

Er präsentierte damit eine Blaupause, wie man kontinuierliche Verbesserung oder Kaizen in einer pharmazeutischen Produktion implementiert.
Mauro Giusti stieg noch tiefer in die Organisation einer Produktionsanlage für aseptisch abgefüllte parenterale Produkte ein. Er zeigte ein Beispiel für Organisation, Governance und Kompetenzentwicklung der Mitarbeiter. Er betrachtete sowohl die Hard Skills, aber auch die Soft Skills und die verschiedenen Karrierewege, die Mitarbeiter einschlagen können.
Dank an das PDA-Team
Es war sehr anregend und hochinteressant, an dieser virtuellen Konferenz teilzunehmen. Viele gute Ideen und Konzepte boten nicht nur Informationen, auch Kontakte konnten aufgefrischt werden.
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








