
Kann man Qualität messen?
Auszug aus dem GMP-BERATER, Kapitel 1.C, Aufgaben der Qualitätssicherung
6 Min. Lesezeit | von Dr. Christian Gausepohl
Erschienen im LOGFILE 9/2024
Wissen Sie, wie gut Ihr CAPA-System funktioniert, wie hoch der Anteil fristgerecht bearbeiteter Änderungsanträge ist oder welche Abweichungen immer wieder auftreten?
Dies sind Informationen, die Sie – neben vielen anderen Aspekten – zur Bewertung Ihres Pharmazeutischen Qualitätssystems heranziehen könnten. Doch dazu müssen zunächst Daten erhoben und ausgewertet werden, die dann im nächsten Schritt mit einem vorab festgelegten Ziel abgeglichen werden.
Lesen Sie im heutigen Leitartikel von Dr. Christian Gausepohl, worauf es bei der Festlegung von Qualitätskennzahlen und Qualitätszielen ankommt. Mehr zu diesem wichtigen Thema finden Sie demnächst im GMP-BERATER, dem weltweit größten Standardwerk für Qualitätsmanagement in der Pharmaindustrie.
Bewertung des Qualitätssystems
Das pharmazeutische Qualitätssystem und die Qualität von Prozessen und Produkten sollen fortlaufend bewertet werden. Ohne Daten ist weder die Bestimmung des Status Quo noch eine kontrollierte Verbesserung möglich. Für diese Bewertung ist häufig die Qualitätssicherung verantwortlich. Sie sammelt Daten, verdichtet diese, führt Trendanalysen durch und berichtet die Ergebnisse an das Management.
In ihrem Quality-Metrics-Programm gibt die FDA mit ihrer Sichtweise eine gute Darstellung der Zusammenhänge von Produktqualität, cGMP-Compliance, kontinuierlicher Verbesserung und der Verwendung von Qualitätskennzahlen:
- Um sicherzustellen, dass Produkte sicher, wirksam und von ausreichender Qualität sind, gilt die Einhaltung der cGMP-Anforderungen als Mindeststandard.
- Die cGMP-Compliance allein sagt jedoch nicht aus, ob ein Hersteller in Verbesserungen investiert und eine nachhaltige Compliance anstrebt.
- Eine nachhaltige Compliance ist ohne den Fokus auf kontinuierliche Verbesserung schwer zu erreichen.
- Qualitätskennzahlen sind eine objektive Möglichkeit, den Status des Produkt- und Prozesslebenszyklus sowie des Pharmazeutischen Qualitätssystems zu messen, zu bewerten, zu überwachen und zu verbessern.
Ein wirksames pharmazeutisches Qualitätssystem (PQS) gewährleistet sowohl nachhaltige Compliance als auch Robustheit der Supply Chain.
Qualitätskennzahlen können dazu beitragen, die Wirksamkeit des PQS aufzuzeigen und zu verbessern.
Kennzahlen
Kennzahlen sollen Arbeitsleistung, Prozesse, Qualität und Kosten messbar machen und eine Steuerung erlauben. Mit ihrer Hilfe können Ziele vereinbart bzw. deren Erreichen gemessen werden. Die Ziele sollten SMART formuliert sein.
Bei der Festlegung dieser Kennzahlen sollten die Steuerungs- und Überwachungsbedürfnisse der obersten Leitung, z. B. Geschäftsleitung, und der operativen Bereiche berücksichtigt werden. Für die oberste Leitung sind die strategischen Ziele und zugehörigen Verbesserungsprojekte sowie der operative Betrieb inkl. PQS von primärer Bedeutung. Dazu werden Qualitätskennzahlen (Key Performance Indicators) festgelegt. Diese setzen sich idealerweise fort in den Kennzahlen der operativen Bereiche. Ohne diese Synchronisation liegt keine sinnvolle Verknüpfung zwischen operativen und strategischen Zielen vor (Abbildung 1).
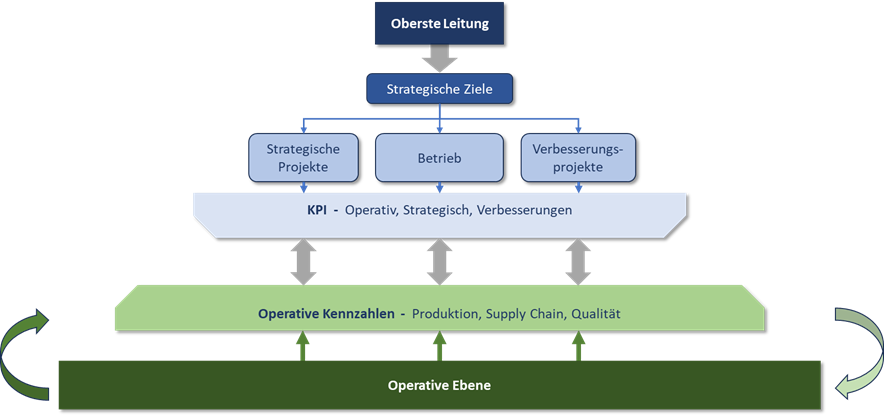
Abbildung 1 Zusammenhang zwischen Key Performance Indicators (KPI) und operativen Kennzahlen
Festlegung von Qualitätskennzahlen
Bei der Festlegung der Kennzahlen sollte klar sein, welche Aussagen hieraus abgeleitet werden können und welche Ziele damit verfolgt werden. Abbildung 2 zeigt Beispiele für typische Qualitätskennzahlen und deren Aussageziele.
Die Kennzahlen können auf verschiedenen Ebenen ermittelt werden, z. B. auf Ebene der Betriebsstätte, und dann in den Organisationsebenen durch weitere Informationen aggregiert und verdichtet werden.
Kennzahlen auf Betriebsstätten-Ebene beschreiben neben Supply Chain- und Produktionskennzahlen die Aspekte zur Qualität von Prozessen sowie der Einhaltung von internen Standards (operative Kennzahlen). Sie berücksichtigen sowohl die Produkte bzw. Prozesse als auch das Qualitätssystem. Dabei können neben qualitätsrelevanten Aussagen auch Zusammenhänge zu Ressourcen und deren Auslastung getroffen werden.
Die erfolgreiche Nutzung von Kennzahlen hängt nicht von deren Anzahl ab, sondern von ihrer sinnvollen Auswahl.
Beispiele für Qualitätskennzahlen

Abbildung 2 Beispiele für Kennzahlen und damit verknüpfte Aussageziele
Berichtszeiträume für Qualitätskennzahlen
Monat:
Viele Kennzahlen werden typischerweise im Monatszeitraum erhoben, z. B.:
- Gesamtanzahl der eröffneten Vorgänge, Anzahl der abgeschlossenen und der überfälligen Vorgänge, Durchlaufzeiten, Trends zu
- Abweichungen
- Reklamationen
- OOX-Verfahren
- Änderungen
- CAPA
- Stabilitätsprüfungen
- Effektivität von Änderungen und CAPA
Quartal:
Andere Kennzahlen werden möglicherweise sinnvoller quartalsweise erfasst, um die Übersicht über Leistungen und Risiken zu erhalten. Hierzu gehören z. B.
- Ergebnisse von Selbstinspektionen und Audits
- Fristeneinhaltung von PQR und OPV
- Übersicht über die geplanten Validierungsaktivitäten
Projekt:
Der Fortschritt interner Verbesserungsprojekte kann mit projektspezifischen Kennzahlen zusätzlich verfolgt werden. Diese entfallen nach erfolgreicher Umsetzung des Projektes.
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








