
PDA Good Digital Manufacturing Conference 2025: Die digitale Transformation in der pharmazeutischen Herstellung
Bericht von der PDA Good Digital Manufacturing Conference 2025, 20. – 21. Mai 2025
5 Min. Lesezeit | von Dr. Sabine Paris
Erschienen im LOGFILE 15/2025
Die PDA Good Digital Manufacturing Conference fand vom 20. bis 21. Mai 2025 in Basel statt und brachte über 90 Teilnehmer zusammen. Ein zentrales Anliegen der Konferenz war es, aufzuzeigen, wie die Digitalisierung die pharmazeutische Produktion verändert.
Unsere Redakteurin Dr. Sabine Paris hat an der Konferenz teilgenommen und wichtige Erkenntnisse im heutigen Leitartikel zusammengetragen. Einen ausführlicheren Bericht finden Sie im GMP-BERATER – dem unverzichtbaren Portal für Ihre GMP-Compliance.
Die PDA Good Digital Manufacturing Conference fand vom 20. bis 21. Mai 2025 in Basel statt und brachte über 90 Teilnehmer zusammen. Ein zentrales Anliegen der Konferenz war es, aufzuzeigen, wie die Digitalisierung die pharmazeutische Produktion verändert.
In meiner Funktion als Vertreterin des GMP-Verlags nahm ich an der Veranstaltung teil und habe wichtige Erkenntnisse in diesem Artikel zusammengetragen. Einen ausführlicheren Bericht finden Sie im GMP-BERATER – dem unverzichtbaren Portal für Ihre GMP-Compliance.
Evolution vom MANUfacturing zum SMARTfacturing
Michelangelo Canzoneri, Merck, schilderte anschaulich den Weg vom MANUfacturing zum SMARTfacturing. Derzeit erzeugt die Pharmaindustrie vor allem Silos für digitale Lösungen. Dabei gibt es folgende Herausforderungen:
- Unstrukturierte Daten
- Datenverbindung herstellen
- eingefrorene Informationen
Die digitale Transformation ist auch eine emotionale Transformation", betonte er. Außerdem ist ein ganzheitliches Verständnis des Herstellungsprozesses entscheidend. Daten müssen in verschiedenen Formaten betrachtet werden, z. B. Bilder, Spektren, Excel-Dateien und Zeitreihen.
Die Entwicklung von MANUfacturing zu SMARTfacturing benötigt zunächst eine Grundlage, die durch folgende Elemente geschaffen wird (siehe Abbildung 1):
- Prozesstechnologien
- Prozessanalytische Technologien
- Digitale Technologien
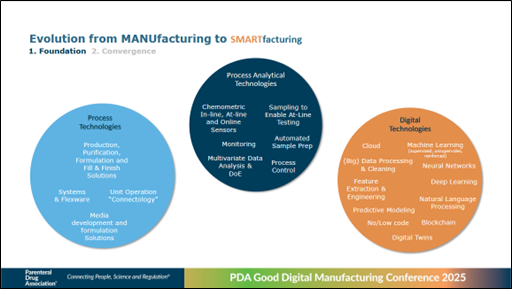
Abbildung 1 Entwicklung von MANUfacturing zu SMARTfacturing (Quelle: Michelangelo Canzoneri, Merck)
Es ist wichtig, dass diese drei Grundpfeiler zusammenkommen, um die autonome Fertigung, QbD, die Intelligenz der Lieferkette und eine modulare Herstellungsanlage zu nutzen.
Zwischen 2022 und 2024 wurden in der Pharmaindustrie erhebliche Schritte unternommen, um den Reifegrad von digitalen Anlagen zu erhöhen. Derzeit haben 41 % der Hersteller weltweit intelligente Technologien eingeführt
Vorteile der Implementierung von KI-Modellen
Davide Botta und Maria Zunica von Recordati in Irland stellten einen Anwendungsfall für eine spezielle API-Anlage mit kontinuierlicher Produktion vor. Vor der Implementierung von KI-Modellen kam es zu einem vorübergehenden Ertragsrückgang von über 4 % bei gleichzeitig hoher Ertragsvariabilität (± 7 %). Außerdem gab es Datensilos, z. B. papierbasierte Chargenprotokolle, die nicht miteinander kommunizieren konnten.
Es wurden verschiedene Vorhersagemodelle eingeführt (siehe Abbildung 2):
- Chargen-Vorhersagemodell
- Modell zur Vorhersage der jährlichen Ausbeute
- Zeitreihen-Clustermode
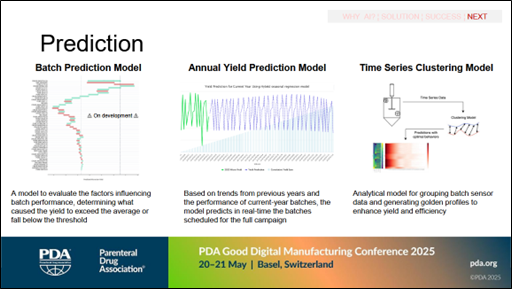
Abbildung 2 Vorhersagemodelle (Quelle: Davide Botta und Maria Zunica, Recordati)
Um aus Echtzeit-Vorhersagen einen tatsächlichen Nutzen zu ziehen, muss die Kontextualisierung der Daten automatisiert werden.
Die greifbaren Ergebnisse waren: höhere Erträge (+ 1,5 % in 3 Monaten), geringere Variabilität sowie 2 % weniger Cost of Goods Sold (Selbstkosten).
Toni Manzano von Aizon sagte, dass KI dabei helfen kann, die Komplexität von Nachhaltigkeitsfragen zu bewältigen. Die WHO hat eine Initiative mit dem Titel "Greener Pharmaceuticals' Regulatory Highway" ins Leben gerufen, um den ökologischen Fußabdruck von Arzneimitteln zu verringern und gleichzeitig hohe Sicherheits- und Wirksamkeitsstandards zu wahren.
Toni Manzano stellte drei Beispiele vor, bei denen KI geholfen hat:
- Die Gesamtanlageneffektivität (Overall Equipment Effectiveness, OEE) einer Produktionslinie konnte durch den Einsatz von IIoT (Industrial Internet of Things), Cloud und KI innerhalb von 6 Monaten um 35 % gesteigert werden.
- Vorausschauende Wartung: Vorhersage der Zeit bis zum nächsten Ausfall (time to next failure, TTNF) und Empfehlung von Maßnahmen zur Vermeidung des nächsten Ausfalls
- VOC-Emissionen (flüchtige organische Verbindungen) und Optimierung des Kühlprozesses durch die Verwendung sequenzieller Prozesse anstelle paralleler Prozesse: Nach zwei Monaten 17 % Energieeinsparung bei den Kühlprozessen und keine Emissionsvorfälle (vorher mehrere pro Monat)
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








