
Shop-Floor-QS: Qualitätssicherung an vorderster Front
Gekürzter Auszug aus dem GMP-BERATER, Kapitel Kapitel 1.C Aufgaben der Qualitätssicherung
5 Min. Lesezeit | von Dr. Christian Gausepohl
Erschienen im LOGFILE 15/2024
Qualität entsteht nicht durch Zufall. Sie kann auch nicht in ein Produkt hineingeprüft werden. Qualität muss vielmehr von Anfang an bei jedem Schritt in der komplexen Prozesskette der Arzneimittelherstellung bewusst erzeugt werden.
Was liegt da näher, als die Qualität direkt am Ort der Entstehung proaktiv sicherzustellen?
Lesen Sie in unserem heutigen Leitartikel von Dr. Christian Gausepohl, welche Chancen die operative Qualitätssicherung bietet und was Sie bei der Einführung beachten sollten.
Eine ausführliche Darstellung der Aufgaben der Qualitätssicherung und ihrer möglichen Organisationsformen finden Sie im GMP-BERATER, dem weltweit größten Standardwerk für Qualitätsmanagement in der Pharmaindustrie.
Das Vorhandensein eines Pharmazeutischen Qualitätssystems (PQS) wird in allen GMP-relevanten Regularien gefordert. Umso erstaunlicher ist es, dass man dort vergeblich nach Vorgaben hinsichtlich der Organisationsform, der Funktion im Unternehmen oder gar einer Leitungsfunktion sucht.
Ungeachtet der Tatsache, dass keine konkreten Anforderungen festgelegt sind, hat sich die Qualitätssicherung als Organisationseinheit in den pharmazeutischen Unternehmen standardmäßig etabliert. Dabei sind die Rolle und die Organisationsform abhängig von der Größe und Komplexität des Unternehmens.
Der Mangel an konkreten Vorgaben hat durchaus auch etwas Positives: jedes Unternehmen kann die Organisation der Qualitätssicherung optimal an die eigenen Bedürfnisse anpassen!
Nachfolgend soll eine mögliche Variante – die Shop-Floor-QS - kurz vorgestellt werden.
Qualitätssicherung vor Ort
Das Einbringen der Qualitätssicherungsfunktion in die operativen Prozesse und den arbeitstäglichen Fertigungsbetrieb vor Ort – auch als Shop-Floor-QS bezeichnet –kann viele Vorteile bieten. Schließlich entsteht Qualität direkt vor Ort im operativen Umfeld und nicht durch spätere Überprüfung. Die Einhaltung der Vorgaben, deren permanente Überprüfung und Verbesserung tragen zu robusten Prozessen und Qualitätssystemen bei. Dabei steht die konstruktive Zusammenarbeit mit dem operativen Bereich im Vordergrund und nicht die reine Überwachung als Quasi-Polizeifunktion – die sachlich richtige Überprüfung ist jedoch selbstverständlich.
Im Grundgedanken soll die Shop-Floor-QS folgende Ziele ermöglichen:
- direkte vor-Ort-Unterstützung der operativen Bereiche im Schichtbetrieb an allen Arbeitstagen
- direkte und zeitnahe Einbeziehung bei Problemen und möglichen Problemen sowie Mitwirkung bei deren Bearbeitung
- regelmäßige Überprüfungen und Beobachtungen im operativen Bereich
Abbildung 1 zeigt eine Übersicht über die möglichen Aufgabenfelder einer Shop-Floor-QS.
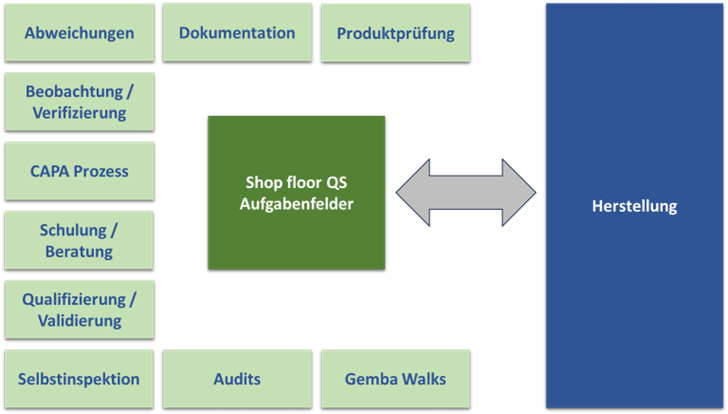
Abbildung 1 Mögliche Aufgabenfelder für die Shop Floor QS
So gelingt die Einführung der Shop-Floor-QS
Für die erfolgreiche Einführung der operativen Qualitätssicherung in den Betrieb gilt es einige Aspekte zu berücksichtigen.
Eine solche Einführung ist eine bewusste Entscheidung für die Zusammenarbeit zwischen Qualitätssicherung und dem operativen Bereich. Sie bietet dabei die Chance, möglicherweise vorhandene Silos zwischen den Bereichen aufzubrechen. Grundsätzlich bedarf es Zeit, Ressourcen und Unterstützung durch die Führung, um dies nachhaltig erfolgreich zu machen und die möglichen Vorteile zu realisieren. Es ist das Ziel, eine gute Balance zu finden zwischen Kontrollfunktionen und gemeinsamer Arbeit an Problemen und Verbesserungen.
Abbildung 2 zeigt eine erfahrungsbasierte Übersicht über die Erfolgsfaktoren einer solchen Shop-Floor-QS.
| Erfolgsfaktoren für eine operative Qualitätssicherung (Shop-Floor-QS) |
|
Abbildung 2 Erfolgsfaktoren der Shop-Floor-QS
Eine wesentliche Grundlage für die Zusammenarbeit ist, dass die QS-Mitarbeiter von den Mitarbeitern des operativen Bereichs akzeptiert werden. Dabei spielen folgende Faktoren eine wichtige Rolle:
- Erfahrung und Wissen zu Produkten und Prozessen
- Kenntnis und Verständnis der Qualitätsanforderungen
- Kommunikationsfähigkeit
- Entscheidungsfähigkeit
- Konfliktfähigkeit
Viele wichtige Aufgaben der QS sind beobachtender und bewertender Natur, so dass Mitarbeiter des operativen Bereichs möglicherweise durch negative Rückmeldungen irritiert sind. Dies kann unter anderem zu emotionalen Diskussionen über die Kompetenz und Erfahrung der QS-Mitarbeiter führen. Daher sind Soft Skills wie Kommunikationsfähigkeit, Entscheidungsfähigkeit und Konfliktfähigkeit neben der Fachkompetenz von Bedeutung. Es muss sorgfältig abgewogen werden, QS-Mitarbeiter dort einzusetzen, die vormalig in genau dieser operativen Einheit tätig waren.
Wenn es vor Einführung einer Shop-Floor-QS bereits Funktionen in der Qualitätssicherung gibt, die sehr stark operativ tätig und eingebunden sind und damit Erfahrungen in der Zusammenarbeit auf Detailebene vorliegen, dann erleichtert dies den Übergang für beide Bereiche. Die gemeinsame Einbindung bzw. Nutzung von Lean-Management-Werkzeugen im arbeitstäglichen Betrieb, wie z.B. Visual Management, 5S, Kaizen oder Standard Work, ermöglicht es, hier gemeinsam hineinzuwachsen, sich weiterzuentwickeln und kontinuierlich zu verbessern.
Der Einführungsprozess sollte durch die Führungskräfte beobachtend begleitet werden. Dabei muss klar gemacht werden, dass die Beobachtung vor allem der Verbesserung von Prozessen und Produkten und damit schlussendlich der Patientensicherheit dient. Dies sollte als gemeinsames Ziel vermittelt werden. Die Shop-Floor-QS sollte sich nicht als reine Kontrollinstanz verstehen und verhalten.
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








