
GDP-Mangel: Unzureichende Berücksichtigung des Transports bei der Erst-Qualifizierung eines Logistikdienstleisters
Auszug aus dem GMP-BERATER, Kapitel 16.S.2.5, Unzureichende Berücksichtigung des Transports
7 Min. Lesezeit | von Lea Joos
Erschienen im LOGFILE Leitartikel 36/2021
Der Mangelpunkt
Im Rahmen der Erst-Qualifizierung des Logistikdienstleisters wurde der Transport nicht ausreichend berücksichtigt. Auf folgende Punkte wurde nicht eingegangen:
- Umgang mit den Transportfahrzeugen
- Verwendung von Umschlagpunkten während des Transports
- Schulung der Fahrer
- Meldung von Abweichungen
(Ref.: EU-GDP-Leitlinie Kapitel 2.4 und 9.2)
Das war das Problem
Ein GDP-konformer Transport trägt wesentlich zum Erhalt der Arzneimittelqualität bei. Außerdem ist gerade auch auf dem Transportweg darauf zu achten, dass das Arzneimittel die legale Vertriebskette nicht verlässt. Die hierfür notwendigen Maßnahmen müssen vom Logistikdienstleister ergriffen werden, wenn dieser die Verantwortung für den Transport übernimmt. Ob die Maßnahmen ausreichend sind, muss der Auftraggeber vor Aufnahme der Zusammenarbeit überprüfen. Die Überprüfung muss sich dabei auf alle Punkte des Transports beziehen.
So vermeiden Sie diesen Fehler
Detaillierte Ausführungen zum Risikomanagement in der Transportkette und zur Transportvalidierung sind bereits an anderer Stelle beschrieben (siehe Kapitel 16.M Risikomanagement in der Transportkette und Kapitel 16.Q Transportverifizierung). Hier soll nur beispielhaft eine Strategie aufgezeigt werden, anhand der bei der Qualifizierung von Transportdienstleistern vorgegangen werden kann. Diese Strategie soll dabei helfen, dass keine wesentlichen Punkte übersehen oder vergessen werden.
Schritt 1: Stellen Sie sich das Transportfahrzeug bildlich vor. An welchen Stellen ist eine Beeinflussung der Arzneimittelqualität oder des Verbleibs in der legalen Lieferkette möglich?
Schritt 2: Gehen Sie genauso mit dem Lieferweg vor. Wie sieht dieser konkret aus? Abbildung 16.S-12 zeigt einen beispielhaften, noch sehr vereinfachten Lieferweg:
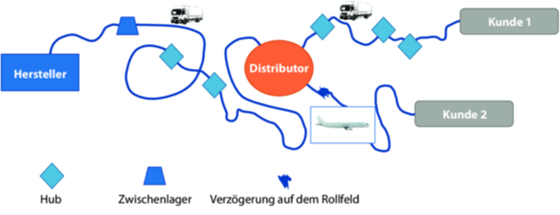
Abbildung 16.S-12 Beispielhafter Transportweg für ein Arzneimittel (auszugsweise); Hub = Hauptumschlagspunkt
Gehen wir davon aus, dass es sich bei dem Distributor in Abbildung 16.S-12 um den vom Großhändler beauftragten Logistikdienstleister handelt, der sowohl den Transport vom Hersteller zu sich als auch an seine Kunden verantwortet. Stellen Sie sich folgende Fragen mit Blick auf den Lieferweg:
- Was sind die kritischen Punkte beim Transport?
- An welchen Punkten besteht ein Risiko einer Beeinträchtigung der Qualität des Arzneimittels oder das Risiko des Verlassens der legalen Vertriebskette?
Schritt 3: Erstellen Sie anhand entsprechender Schaubilder für den tatsächlichen Transportweg Ihres Arzneimittels eine Liste der kritischen Punkte.
Schritt 4: Überprüfen Sie alle kritischen Punkte im Rahmen der Qualifizierung des Auftragnehmers, der für Sie den Transport durchführt oder weiter untervergeben hat.
Wie könnte die Überprüfung eines kritischen Punktes aussehen? Dies soll an einem Beispiel ausführlich beschrieben werden.
Ein kritischer Punkt beim Transport des Arzneimittels könnte z. B. der Umschlag in einem Hub sein. Was passiert in einem Hub mit der Arzneimittelpalette? Abbildung 16.S-13 zeigt die möglichen Schritte für den Umschlagprozess in einem Hub.
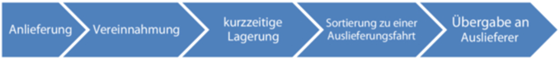
Abbildung 16.S-13 Beispiel Umschlagprozess in einem Hub
Welche Prüfkriterien könnten zu den einzelnen Schritten des Umschlagprozesses aus Abbildung 16.S-13 angelegt werden?
Gehen Sie dazu den Prozess Schritt für Schritt durch. Was passiert wann mit der Arzneimittelpalette?
Bei der Übergabe vom Fahrer an den Hub könnten folgende Punkte zu prüfen sein:
- Ist der Wetterschutz angemessen?
- In welcher Form wird geprüft, ob die Anlieferung stimmt (richtiges Produkt, richtiger Hub)?
- Wie wird ggf. bei Anlieferung überprüft, ob die Transportbedingungen eingehalten wurden?
Folgende Tätigkeiten und Merkmale des Hubs müssen betrachtet werden:
- Werden die Umgebungsbedingungen (Temperatur und relative Feuchte) überwacht?
- Wurden Einflüsse von Jahreszeiten auf die Umgebungsbedingungen berücksichtigt? Z. B. Hitze- oder Kälteeinwirkung durch offene Rolltore.
- Sind die gesetzten Grenzwerte für die Umgebungsbedingungen akzeptabel?
- Wie wird mit Überschreitungen der Grenzwerte für Umgebungsbedingungen umgegangen?
- Sind die Räume baulich einwandfrei und sauber?
- Existiert ein Konzept zur Schädlingskontrolle?
- Wie werden bei der Sortierung zu einer Auslieferungsfahrt Fehler vermieden?
- Sind eventuelle Lagerbereiche für Arzneimittel separat?
- Werden Abweichungen dokumentiert und an den Auftraggeber weiter kommuniziert?
Bei der Übergabe vom Hub an den Auslieferungsfahrer sind wiederum ähnliche Punkte relevant, wie bei der Übergabe vom Anlieferungsfahrer an den Hub:
- Ist der Wetterschutz angemessen?
- In welcher Form wird sichergestellt, dass der annehmende Fahrer entsprechend beauftragt und geschult ist?
- Wie wird die Richtigkeit der Zuordnung Ware – Fahrt überprüft?
Die Überprüfung all dieser Punkte kann in zwei verschiedene Bereiche fallen (siehe auch Abbildung 16.S-10).
- Entweder sind diese Punkte im Qualitätsmanagementsystem des Logistikdienstleisters beschrieben. Dann führt der Logistikdienstleister den Transport selbst, mit eigenen Hubs und eigenem Personal, durch (y2 in Abbildung 16.S-10).
- Oder der Logistikdienstleister hat den Transport an Dritte untervergeben – inklusive der von den Transporteuren verwendeten Hubs (y1 in Abbildung 16.S-10).
Üblicherweise werden Sie die zweite Konstellation vorfinden. Bei dieser Konstellation muss beim Logistikdienstleister mindestens eine Qualifizierung des Transportdienstleisters inklusive der Hubs und nachgelagerter Depots vorliegen. Es ist dann Ihre Aufgabe, die Qualifizierung des Transportdienstleisters durch den Logistikdienstleister zu überprüfen.

Abbildung 16.S-14 Berücksichtigung des Transports bei der Qualifizierung von Logistikdienstleistern
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








