
Horizontal, vertikal oder verkettet: GMP-konformer Materialfluss in der Pharmaproduktion
Ein Auszug aus dem GMP-BERATER, Kapitel 3.B.3
7 Min. Lesezeit | von Andreas Nuhn
Erschienen im LOGFILE Leitartikel 38/2023
In Anlehnung an die mittlerweile zurückgezogene VDI-Richtlinie 3300 ist der Materialfluss die räumliche, zeitliche und organisatorische Verkettung aller Vorgänge bei der Gewinnung, Bearbeitung und Verteilung von Gütern innerhalb festgelegter Bereiche.
Dazu gehören im Einzelnen: Bearbeiten, Handhaben, Transportieren, Prüfen, die Aufenthalte und die Lagerung.
Der Materialfluss hat neben wirtschaftlichen Aspekten einen erheblichen Einfluss auf die GMP-Konformität. Die wichtigsten Aufgaben des Materialflusses und die dazu erforderlichen Eigenschaften sind in Abbildung 1 zusammengefasst.
| Aufgaben und Eigenschaften des Materialflusses | |
| Aufgaben |
|
| Eigenschaften |
|
Abbildung 1: Aufgaben und Eigenschaften des Materialflusses
Horizontaler Materialfluss
Beim horizontalen Materialfluss erfolgt der Transport des Materials auf derselben Ebene wie die Produktion. Dafür werden entsprechende Transporteinrichtungen wie z. B. Hubwagen oder Transportbänder eingesetzt, im einfachsten Fall erfolgt der Transport durch die Mitarbeiter. Die Produktion findet auf einer oder mehreren Ebenen statt, die über Aufzüge miteinander verbunden sind. Der horizontale Materialfluss ist vor allem bei sterilen Arzneiformen weit verbreitet, wird aber auch in Feststoffbetrieben noch immer eingesetzt. Da sowohl für die Produktion als auch für den Transport und die Lagerung der Zwischenprodukte ausreichende Flächen notwendig sind, erfordert diese Variante viel Platz.
Vertikaler Materialfluss
Beim vertikalen Materialfluss, der erstmals von Prof. Lhoest realisiert wurde, wird für den Produkttransport gezielt die Schwerkraft eingesetzt. Die Produktionsanlagen sind über mehrere Ebenen miteinander verbunden. Transport- und Produktionsprozesse finden auf unterschiedlichen Ebenen statt, die über entsprechende Transportsysteme, meistens Rohre, Schneckenförderer usw. miteinander verbunden sind (siehe Abbildung 2). Der vertikale Materialfluss wird hauptsächlich in Feststoffbetrieben eingesetzt. So wird beispielsweise ein Container mit Granulat oberhalb einer Tablettenpresse positioniert. Das Granulat wird unter Nutzung der Schwerkraft über geeignete Zuführungen direkt in die Tablettenpresse geleitet. Die fertigen Tabletten werden wiederum unter Nutzung der Schwerkraft in einen unterhalb der Tablettenpresse befindlichen Container geführt. Durch dieses Materialflussprinzip werden Transportwege von der Produktionsebene (hier die Tablettierung) getrennt. Damit verringert sich der Platzbedarf im eigentlichen Produktionsbereich und das Risiko von Verwechslungen und (Kreuz)-Kontaminationen wird reduziert. Ein wirtschaftlicher Vorteil dieses Konzeptes liegt darin, dass der Platzbedarf für die Prozessschritte mit den höchsten GMP-Anforderungen minimiert werden kann, da die Transportvorgänge in geschlossenen Containern in einer Umgebung mit niedrigeren Reinheitsanforderungen erfolgen können. Diesen Vorteilen stehen allerdings der hohe Automatisierungsgrad und der damit verbundene Validierungsaufwand gegenüber. Auch die Reinigung der Verbindungen kann in der Praxis Probleme bereiten.
Abbildung 2: Prinzip des vertikalen Materialflusses [Pohl, 1999]
Verketteter Materialfluss
Sowohl beim vertikalen als auch beim horizontalen Materialfluss wird eine Verkettung der Anlagen unter GMP-Gesichtspunkten angestrebt. Dies dient nicht nur dem Schutz des Produktes vor Kontaminationen jeglicher Art, sondern auch dem Schutz des Bedienungspersonals vor dem Produkt.
Während der Produktschutz vor allem bei Produkten mit hohen Reinheitsanforderungen (z. B. sterile Arzneiformen) von Bedeutung ist, spielt der Personenschutz bei hochwirksamen oder sensibilisierenden Wirkstoffen eine entscheidende Rolle.
Das Prinzip des verketteten Materialflusses findet seine konsequente Umsetzung im Containment. Die Anlagen werden z. B. über Rohre, Schläuche, Wendeln, etc. fest miteinander verbunden. Im Unterschied zum horizontalen Materialfluss befinden sich bei dieser Variante alle miteinander verbundenen Anlagen auf derselben Ebene.
Das Produkt kann über diese Verbindungselemente von einer Maschine zur nächsten transportiert werden, ohne in Zwischengebinde umgefüllt zu werden (siehe Abbildung 3).
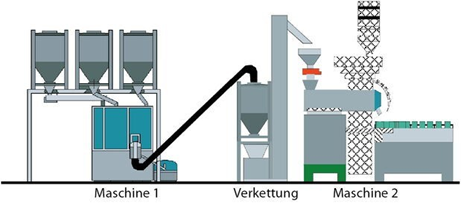
Limitiert wird dieses Verfahren hauptsächlich durch die Transportfähigkeit des Produktes, da hier im Gegensatz zum vertikalen Materialfluss die Schwerkraft nicht genutzt werden kann, sondern das Produkt aktiv gefördert werden muss. Allerdings lassen sich nicht alle Produkte mit den vorhandenen Methoden transportieren, ohne dabei beschädigt zu werden. Außerdem ist die Flexibilität in Bezug auf Produktwechsel und dem Einsatz von Maschinen unterschiedlicher Hersteller mit verschiedenen Kapazitäten eingeschränkt.
Welche Vor- und Nachteile diese drei Materialflussprinzipien haben lesen Sie im Kapitel 3.B.3 des GMP-BERATERs, dem weltweit größten Standardwerk für Qualitätsmanagement in der Pharmaindustrie.
Quelle
Pohl T.: Materialflußvarianten; Diplomarbeit FH Sigmaringen; 1999
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de










