
SOPs GMP-konform anwenden
Auszug aus dem GMP-BERATER, Kapitel 15.D.7, Anwendung
5 Min. Lesezeit | von Dr. Christine Oechslein und Cornelia Wawretschek
Erschienen im LOGFILE Leitartikel 44/2021
Arbeitsanweisungen müssen überall dort vor Ort verfügbar sein, wo die beschriebene Tätigkeit ausgeführt wird – und zwar in der aktuellsten, genehmigten Version.
Es dürfen weder Entwurfsversionen noch Vorgängerversionen zum Arbeiten verwendet werden. Ebenso wenig sind einzelne Seiten aus SOPs oder gar selbst erstellte Kurzfassungen als „Merkzettel“ erlaubt.
Das bedeutet, dass in „glaubhafter Nähe“ zum Arbeitsplatz entweder eine aktuelle, gedruckte SOP-Version oder Zugriff auf das elektronische SOP-System vorhanden sein muss. Papier-SOPs müssen zwar nicht an jeden einzelnen Mitarbeiter in einem Bereich verteilt werden, sondern eine gemeinsame Nutzung ist möglich – aber es muss sichergestellt sein, dass jeder Mitarbeiter den Standort der SOPs kennt und tatsächlich Zugriff hat. Analog gilt für elektronische SOP-Systeme, dass jeder betroffene Mitarbeiter Leseberechtigung für die ihn betreffenden SOPs haben muss.
Mit dem Vorhandensein am Arbeitsplatz beginnt nun der eigentlich „vitale“ Abschnitt im Lebenszyklus einer Arbeitsanweisung: die Anwendung.
Dabei wird der Inhalt der Arbeitsanweisungen – je nach Thema – durchaus unterschiedlich „gelebt“:
- Bei vielen Routineabläufen bleibt die Arbeitsanweisung selbst im Hintergrund und dient lediglich zur Beantwortung einzelner, spezieller Fragen zu einem bestimmten Ablauf oder bei Auftauchen von Sonderfällen.
- Häufig enthalten SOPs in ihren Anlagen Checklisten, die als ständige Begleiter gerade bei wiederkehrenden Alltagsprozeduren dienen sollen, damit in der täglichen Routine nichts vergessen oder übersehen wird.
- Manche SOPs regeln Arbeitsabläufe, die nicht täglich vorkommen. In diesen Fällen muss die SOP unbedingt zu Hilfe genommen und Schritt für Schritt befolgt werden. Es wäre völlig falsch und ein ernster GMP-Verstoß, in solchen Situationen „auswendig“ arbeiten zu wollen.
Eine weitere Anwendungsfunktion von SOPs ist der Einsatz als Schulungsgrundlage. Voraussetzungen für die korrekte Anwendung von SOPs im Arbeitsalltag sind qualifizierte, motivierte Mitarbeiter und erfolgreich durchgeführte, verständliche Schulungsmaßnahmen.
In Abbildung 15.D-7 sind Voraussetzungen für die GMP-konforme Anwendung von Arbeitsanweisungen aufgeführt. Die Zusammenhänge sind in Abbildung 15.D-8 als Wissenstreppe dargestellt.
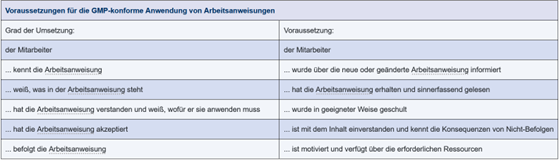
Abbildung 15.D-7 Voraussetzungen für die GMP-konforme Anwendung von Arbeitsanweisungen
 Abbildung 15.D-8 Umsetzung von SOPs und notwendige Voraussetzungen
Abbildung 15.D-8 Umsetzung von SOPs und notwendige Voraussetzungen
Haben Sie Fragen oder Anregungen? Bitte schreiben Sie uns: redaktion@gmp-verlag.de








